Dra. Beatriz de Araújo Cortez
Introdução
O citoesqueleto é formado por redes proteicas presentes no citossol que estão relacionadas a diversas funções celulares. Dentre elas podemos citar: manter a forma da célula e dar suporte a membrana plasmática, permitir a adesão da célula ao substrato e sua locomoção, conferir resistência mecânica a célula, servir como vias para o tráfego e no posicionamento de organelas, atuar na contração muscular e ainda na segregação dos cromossomos durante a divisão celular. Alguns elementos do citoesqueleto possuem comportamento muito dinâmico. Podem-se alongar ou encurtar rapidamente dependendo da necessidade da célula. Este constante remodelamento do citoesqueleto depende, na maioria das vezes, do gasto de energia, evidenciando como é essencial a manutenção desse dinamismo para que a célula possa responder a diferentes estímulos.
O citoesqueleto em células eucariontes é amplamente estudado. Três elementos principais podem ser identificados: os filamentos intermediários, microtúbulos e filamentos de actina. Cada elemento é formado por um tipo de proteína ou famílias de proteínas que conferem propriedades distintas a cada um deles. Porém, muitas das funções relacionadas ao citoesqueleto dependem de outras proteínas associadas aos filamentos que os conectam a organelas ou outros componentes celulares, ou ainda a outros filamentos. Dentre essas proteínas associadas destacam-se as proteínas motoras que são capazes de “caminhar” sobre alguns filamentos utilizando energia proveniente da hidrólise de ATP e trazendo consigo diferentes organelas ou outros componentes celulares.
Os microtúbulos e filamentos de actina possuem características em comum, que não são compartilhadas com os filamentos intermediários: servem de vias para as proteínas motoras trafegarem com seus ligantes, possuem um sítio de ligação a nucleosídeos trifosfatados, são formados por subunidades globulares e formam filamentos polarizados (com extremidades com propriedades distintas). Já os filamentos intermediários não estão ligados a nucleosídeos trifosfatados, apresentam extremidades iguais, são formados por proteínas fibrosas e estão primordialmente relacionados a transmitir força mecânica e a resistência a deformações.
Já em procariontes, acreditava-se não haver citoesqueleto, mas partir dos anos 90 foram descobertos homólogos de tubulina, actina, e proteínas com funções semelhantes aos filamentos intermediários. Diversas funções destas proteínas foram relacionadas à manutenção da forma celular, divisão celular e segregação do DNA plasmidial. Porém, nenhuma proteína motora foi identificada em procariontes, o que parece limitar a atuação do citoesqueleto nestes organismos quando comparado ao dos eucariontes.
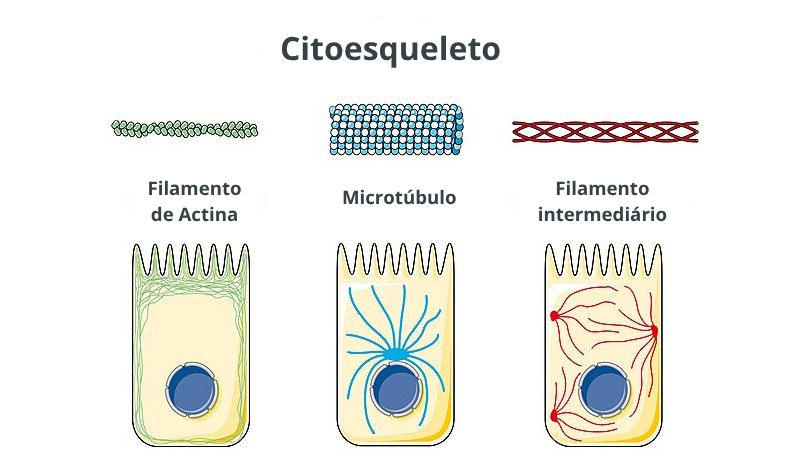
Figura 1 – Esquema geral do citoesqueleto, mostrando seus três componentes e principais localizações: filamento de Actina, microtúbulo e filamento intermediário. Adaptado de: Laboratoires Servier / Wikimedia. CC-BY-SA-3.0. Fonte: https://commons.wikimedia.org/wiki/File:Cytoskeleton_-_Actine_filament_Microtubule_Intermediate_filament_–_Smart-Servier.jpg
Filamentos intermediários
Como já mencionado este elemento do citoesqueleto é o responsável por conferir resistência mecânica à célula, já que são os filamentos mais duráveis e resistentes dentre todos. Também são muito flexíveis podendo resistir a estiramentos de até 3X seu comprimento original. Um bom exemplo destas características dos filamentos intermediários são os fios de cabelo, formados por filamentos de queratina, muito flexíveis e resistentes.
Diferentemente dos microtúbulos e filamentos de actina, os filamentos intermediários são um conjunto de filamentos formados por proteínas diferentes, mas que tem em comum a maneira como são formados e muitas das suas propriedades e funções dentro da célula. Por exemplo, em humanos cerca de 70 genes codificam proteínas que formam filamentos intermediários, e estas estão distribuídas em grandes famílias de proteínas, como as queratinas, vimentinas, desminas e laminas. Porém, todos estes filamentos são semelhantes e apresentam muitas características em comum, já que a estrutura das suas proteínas é semelhante: elas apresentam um domínio central alongado, e as extremidades N e C-terminal globulares. O domínio central destas proteínas é conservado, mas as extremidades globulares diferem de acordo com a proteína, conferindo propriedades específicas aos filamentos. É válido lembrar que os filamentos são sempre formados a partir de proteínas de uma mesma família, e não são encontrados filamentos mistos. Já proteínas de uma mesma família podem interagir na formação dos dímeros, formando heterodímeros, como ocorre na formação de filamentos de queratinas.
Existe uma classificação dos filamentos intermediários de acordo com as proteínas que os formam. Quatro grandes classes são encontradas: filamentos de queratina presentes em células epiteliais; filamentos de vimentina e relacionados a vimentina presentes no tecido conjuntivo, células musculares e de suporte do sistema nervoso; neurofilamentos em neurônios e lâminas nucleares em todas as células animais. A família das queratinas é considerada a mais diversificada, com mais 50 representantes em humanos. Mais de 20 queratinas diferentes já foram identificadas em células epiteliais, sendo que cada tipo de epitélio pode expressar um conjunto diferente de queratinas. Essa distinção dos epitélios de acordo com as queratinas que são expressas é uma informação importante no diagnóstico e tratamento de câncer, uma vez que o conjunto de queratinas presentes nas células tumorais pode indicar em qual epitélio a doença se originou.
Os filamentos intermediários estão distribuídos pelo citossol, formando redes proteicas, e também estão presentes no envoltório nuclear, como veremos mais adiante. São encontrados em abundância em células submetidas a estresse mecânico, como axônios de células nervosas, células musculares e epiteliais. Já alguns outros tipos celulares podem apenas apresentar filamentos intermediários na lâmina nuclear, e nenhum filamento intermediário no citossol.
Os filamentos intermediários formam estruturas semelhantes a cordas ou cabos de aço, com fitas longas enoveladas entre si. As fitas correspondem a proteínas fibrilares alongadas, que interagem entre si pelo domínio central formado por α hélices que favorecem a interação entre eles. O entrelaçamento de dois domínios centrais leva a formação de dímeros, que por sua vez interagem lateralmente com outros dímeros formando tetrâmeros. Estes tetrâmeros são solúveis e considerados as subunidades funcionais dos filamentos intermediários, análogos aos monômeros de actina e ao dímero de α e β tubulina. Na formação dos tetrâmeros os dímeros apontam para direções opostas, o que faz com que as extremidades dos tetrâmeros sejam iguais, não conferindo polaridade a estes filamentos. A associação de 8 tetrâmeros forma os filamentos semelhantes a cordas. A associação das subunidades é uma reação favorável, uma vez que baixas concentrações das subunidades livres no citossol desencadeiam a formação dos filamentos. Este processo ainda não é completamente compreendido, mas hoje se sabe que o crescimento dos filamentos pode ocorrer igualmente a partir das suas duas extremidades.
Após formados os feixes de filamentos, estes ainda podem interagir lateralmente e formar estruturas mais robustas e resistentes, como observados em alguns neurofilamentos que conferem estabilidade aos longos processos neuronais. Os feixes também podem ser estabilizados e reforçados por proteínas acessórias, como a plectina, que conecta filamentos entre si e também filamentos aos microtúbulos, filamentos de actina e proteínas dos desmossomos. Outro exemplo é a proteína acessória flagrina que liga filamentos de queratina presentes nas células do epitélio formador da pele, conferindo a esses filamentos o arranjo espacial necessário para formação da pele. Nenhuma proteína motora foi identificada caminhando sobre os filamentos intermediários, mas os estes filamentos podem ser “carregados” por proteínas motoras associadas aos microtúbulos.
A maior família de proteínas associadas a filamentos intermediários é a família das plaquinas. Estas proteínas possuem sítios de ligação à filamentos intermediários e também a outros elementos do citoesqueleto e à junções celulares de adesão. Com o auxílio destas e outras proteínas acessórias, como a plectina e desmoplaquina, os filamentos intermediários se ligam aos desmossomos, junções celulares de adesão que ligam células epiteliais ou musculares adjacentes, e aos hemidesmossomos que ligam as células a matriz extracelular. Por exemplo, via desmossomos o citoesqueleto de células de um epitélio podem se conectar e tornar toda a camada de células mais resistente à tração além de mantê-las unidas.
Os filamentos intermediários também são considerados mais estáveis e menos dinâmicos que os microtúbulos e filamentos de actina, sendo resistentes a altas temperaturas e concentração de sais. Porém alguns tipos de filamentos apresentam grande dinâmica e são capazes de trocar suas subunidades rapidamente, como já demonstrado em filamentos de vimentina. Outro exemplo de filamento que apresenta uma dinâmica mais intensa são os formadores da lâmina nuclear. Esta é uma folha ou tela formada por filamentos de laminas A, B e C, que se conecta a membrana nuclear interna presente no envoltório nuclear. Ela dá suporte ao núcleo e mantem a sua forma. Esta rede de filamentos é considerada dinâmica uma vez que deve ser desfeita durante o início da mitose juntamente com todo o envoltório nuclear, e deve ser reorganizada ao final da telófase. A dissociação da lamina nuclear ocorre a após sua fosforilação pela ação do complexo promotor da mitose, indicando que a dissociação de filamentos intermediários pode ser decorrente da fosforilação dos filamentos.
Microtúbulos
Os microtúbulos são polímeros proteicos em forma de tubos que participam de diversas funções celulares, como posicionamento de transporte de vesículas e organelas membranosas, formação de cílios e flagelos e formação dos fusos mitóticos durante a mitose. Todos os microtúbulos que formam a rede observada no citossol de células interfásicas e os formadores dos fusos mitóticos durante a mitose têm seu inicio no centrossomo, uma organela não delimitada por membrana localizada próxima ao núcleo, e a partir dele crescem podendo formar longos filamentos ocos e dinâmicos.
Os microtúbulos são formados por heterodímeros de α e β tubulina. Estas duas proteínas são codificadas por genes diferentes que possuem 40% de similaridade. Logo após a tradução elas se associam e formam heterodímeros estáveis no citossol, que dificilmente se dissociam. Estes dímeros são as subunidades dos microtúbulos. Tanto a α quanto a β tubulina possuem um sítio de ligação a GTP, porém o GTP presente na α tubulina está imerso na estrutura da proteína e nunca é hidrolisado a GDP. Já a molécula de GTP ligado a β tubulina pode ser hidrolisada em GDP, e possui papel importante no processo de polimerização e despolimerização dos microtúbulos.
Portanto no citossol existe um conjunto subunidades de tubulina livres e microtúbulos já polimerizados. Como descrito acima cada dímero de tubulina contem uma molécula de GTP, o que favorece a ligação do dímero a outros dímeros já presentes nos microtúbulos, levando ao crescimento do microtúbulo. Porém, após a adição da subunidade ao microtúbulo ocorre a hidrólise do GTP em GDP, o que altera a conformação da subunidade e favorece a despolimerização destes. Quando a polimerização, ou seja, a adição de subunidades de tubulina ao microtúbulo, é mais rápida que a hidrólise do GTP ocorre o crescimento dos microtúbulos. Na situação inversa, quando a polimerização é mais lenta que a hidrólise, ocorre o encurtamento ou despolimerização, chamada de catástrofe. A extremidade em crescimento de um microtúbulos então sempre é formada por subunidades ligadas a GTP, o que forma a chamada capa ou quepe de GTP. Já o restante do microtúbulos é formado por subunidades ligadas a GDP, e quando a despolimerização ou catástrofe se inicia e atinge essa região do microtúbulo ela tende a ser contínua, sendo esse momento chamado de rápido encurtamento. Quando uma subunidade se solta do microtúbulo e fica livre no citossol o GDP é trocado por uma molécula de GTP, e a subunidade está novamente pronta para ser adicionada a um microtúbulo. Numa célula os microtúbulos estão continuamente crescendo e encurtando, e a proporção de subunidades livres no citossol e presentes nos microtúbulos se mantem. Essa constante polimerização/despolimerização é chamada de instabilidade dinâmica.
Em relação a organização dos dímeros na formação dos microtúbulos, podemos observar que os microtúbulos podem ser divididos em protofilamentos, que são sequencias lineares de subunidades de tubulina que quando unidas lateralmente formam a parede do tubo. Nas células os microtúbulos são normalmente formados por 13 protofilamentos, embora também seja possível observar microtúbulos com 11 a 16 protofilamentos. Quando ocorre a despolimerização dos microtúbulos levando a seu encurtamento os protofilamentos podem ser observados sendo liberados a partir da extremidade do microtúbulo.
Os microtúbulos são polarizados pois possuem duas extremidades distintas: uma chamada de extremidade mais e outra de extremidade menos. Isso ocorre, pois, as subunidades de tubulina são acrescidas sempre na mesma orientação, com a β tubulina direcionada a extremidade mais e a α orientada para a extremidade menos. A extremidade mais tem a capacidade de polimerizar e despolimerizar mais rapidamente que a extremidade menos, sendo mais dinâmica. Porém, em uma célula animal a extremidade menos dos microtúbulos está imersa no centrossomo, e, portanto, não sofre polimerização/despolimerização.
Os centrossomos são os centros organizadores de microtúbulos, uma organela não membranosa de onde se irradiam todos os microtúbulos de uma célula, já que a polimerização espontânea no citossol é extremamente difícil de acontecer. Ele é composto por um par de centríolos formados por 9 trincas de microtúbulos estáveis, uma matriz pericentriolar que contem proteínas sempre presentes e proteínas que se encontram somente em determinadas fases do ciclo celular. Uma das proteínas constituintes dos centrossomos é a ƴ tubulina, que forma anéis de onde os microtúbulos de originam. Estes anéis são formados por de 10 a 13 moléculas de ƴ tubulina onde os heterodímeros de α e β tubulina se ligam e iniciam a formação dos microtúbulos, deixando a extremidades menos ligadas a estes anéis.
Os centrossomos estão intimamente relacionados a divisão celular, uma vez que durante a mitose são os polos dos fusos mitóticos, de onde se irradiam os fusos mitóticos. Para que eles formem os polos dos fusos é necessário que se dupliquem, e isso ocorre de forma semiconservativa durante a fase S do ciclo, quando também ocorre na replicação do DNA. Já durante a fase G2 ocorre a maturação dos novos centrossomos com o recrutamento da matriz pericentriolar, e durante a prófase, quando o envoltório nuclear está se fragmentando, ocorre a migração dos centrossomos para os polos opostos e a formação dos fusos mitóticos.
Dependendo do estado e necessidades da célula é interessante manter os microtúbulos estáveis. Algumas proteínas associadas aos microtúbulos são capazes de estabiliza-los e previnem a despolimerização. O corte de microtúbulos longos produzindo filamentos menores também pode ocorrer, e a proteína acessória responsável por essa função é a katanina, que utiliza energia proveniente da hidrólise de ATP para cortar microtúbulos. O corte dos filamentos altera a dinâmica dos microtúbulos, uma vez que novas extremidades mais e menos serão formadas e estarão sujeitas a polimerização e despolimerização.
Já as proteínas acessórias que se ligam lateralmente aos microtúbulos podem estabilizar os microtúbulos ou intermediar a interação destes com outros componentes celulares. Essas proteínas são chamadas de proteínas associadas aos microtúbulos ou MAPs, e possuem um domínio de ligação ao microtúbulo e outro domínio que pode se ligar a outros microtúbulos ou a diferentes componentes celulares. Uma representante das MAPs muito estudada é a Tau, encontrada em abundância em neurônios onde auxilia na formação de feixes estáveis de microtúbulos por onde as vesículas podem “caminhar” do corpo celular até as extremidades da célula.
Outras proteínas acessórias muito estudadas são as proteínas motoras. Estas proteínas permitem que os microtúbulos sirvam de via para o tráfego e posicionamento de vesículas e organelas dentro da célula, portanto, são de extrema importância. Elas são capazes de se ligar aos microtúbulos em um domínio, e em outro se ligam a organelas, vesículas membranosas ou outros microtúbulos ou filamentos. A partir da hidrólise de ATP elas alteram sua conformação e assim são capazes de se locomover sobre os microtúbulos, carregando seus ligantes. Dependendo da extremidade do microtúbulo para onde se direcionam essas proteínas são divididas em dois grandes grupos: as cinesinas são as proteínas motoras que de direcionam para a extremidade mais dos microtúbulos, enquanto que as dineínas “caminham” em direção à extremidade menos dos microtúbulos. Considerando que na maior parte das células a extremidade menos dos microtúbulos está imersa no centrossomo que se localiza próximo ao núcleo, e estes filamentos se alongam em direção a periferia celular apontando suas extremidades mais para a membrana plasmática, de maneira geral podemos dizer que as cinesinas caminham em direção a membrana plasmática e as dineínas em direção ao núcleo.
Estas proteínas são essenciais para o tráfego de vesículas dentro das células, acelerando processos como o transporte de vesículas entre organelas e até a membrana plasmática, e também são essenciais para o posicionamento de organelas dentro da célula. Por exemplo, o complexo de Golgi normalmente se localiza próximo ao núcleo pois suas cisternas encontram-se associadas a dineínas que ao se ligarem aos microtúbulos posicionam-as próximas ao centrossomo, ou seja, próximo ao núcleo. Outro exemplo é o das mitocôndrias que se encontram associadas aos microtúbulos já que estão ligadas a proteínas motoras, e podem ter a sua distribuição alterada dependendo da necessidade da célula. Essa mudança de posicionamento é mediada pelas proteínas motoras.
Em relação a sua estrutura as cinesinas são formadas por duas cadeias leves e duas pesadas e formam duas cabeças motoras globulares e uma cauda alongada, já as dineínas possuem 2 ou 3 cadeias pesadas que incluem o domínio motor e um número bastante variável de cadeias leves e intermediárias.
Os microtúbulos estão presentes no citossol formando uma rede, como já descrito, mas também podem estar em estruturas como cílios e flagelos dependendo do tipo celular. Tanto cílios como flagelos são formados de microtúbulos e dineínas, e são estruturas que apresentam motilidade. Os flagelos são mais longos que os cílios e estão presentes em espermatozoides e protozoários, conferindo mobilidade a estas células. Já os cílios são mais curtos que os flagelos e atuam em conjunto, já que muitos cílios são encontrados em uma única célula e estes se movem simultaneamente, formando padrões ondulatórios. Esse movimento coordenado é capaz de gerar o movimento da célula ou do meio onde a célula se encontra, como no caso de células presentes em um tecido epitelial. No caso do corpo humano, por exemplo, milhares de cílios são encontrados na superfície de células o trato respiratório, e o movimento destes cílios é capaz de movimentar o muco presente nas vias aéreas.
Já a estrutura dos cílios e flagelos é bastante semelhante. Ambos são formados por um arranjo especial de microtúbulos denominado axonema. O axonema é formado por 9 duplas de microtúbulos que com o auxílio de proteínas acessórias chamadas nexinas se unem formando uma estrutura anelar ao redor de uma dupla de microtúbulos. Essa estrutura também é conhecida como 9+2. Entre as duplas de microtúbulos que formam a estrutura anelar também são encontradas proteínas dineínas que só ocorrem nos flagelos e cílios, chamadas de dineínas ciliares. Essas dineínas possuem dois sítios de ligação a microtúbulos, e se ligam a microtúbulos provenientes de duplas adjacentes, como se fossem caminhar sobre um microtúbulo tendo como cargo o microtúbulo da dupla adjacente. Porém, as duplas estão estabilizadas lateralmente pelas nexinas, o que impossibilita o deslocamento de uma dupla em relação a outra. O movimento das dineínas então promove a curvatura dos microtúbulos, o que leva ao dobramento de todo o axonema e confere movimento do cílio ou flagelo.
Os cílios e flagelos em células eucarióticas se formam a partir de estruturas chamadas de corpos basais, localizados próximos a superfície celular de onde irão se projetar essas estruturas. Os corpos basais são muito semelhantes aos centríolos presentes nos centrossomos, formados por um anel de nove trincas de microtúbulos.
Além da rede de microtúbulos presente nas células interfásicas e cílios e flagelos, os fusos mitóticos também são formados por microtúbulos. Como descrito acima os fusos são formados a partir dos centrossomos ou pólos dos fusos durante a mitose após o completo remodelamento dos microtúbulos, que passam de uma rede distribuída pelo citoplasma para feixes que irão promover a segregação dos cromossomos. O remodelamento drástico dos microtúbulos é desencadeado pela fosforilação destes pelo complexo Cdk1-CiclinaB, que via fosfosrilação desencadeia diversas alterações na célula necessárias a mitose. Os fusos são formados por feixes de microtúbulos, divididos em três classes: os microtúbulos ligados a cinetócoros, que são os feixes que se conectam aos cromossomos, os microtúbulos astrais que se conectam a membrana plasmática, e os microtúbulos interpolares que são feixes longos provenientes dos polos apostos que se interpolam e deslizam uns sobre os outros. Esse deslizamento dos fusos interpolares depende da ação de proteínas motoras, e é responsável por distanciar os polos opostos. Já os feixes ligados a cinetócoros são dinâmicos e despolimerizam segregando as cromátides irmãs para os polos opostos. Os fusos astrais também despolimerizam e aproximam os polos da membrana plasmática, auxiliando na separação dos polos e também dos cromossomos.
Algumas drogas atuam sobre os microtúbulos, e vem sendo utilizadas para o tratamento de câncer. Elas interferem na polimerização dos microtúbulos fazendo com que estes não cresçam ou despolimerizem. Quando uma célula tratada com essas drogas entra na fase M do ciclo celular os fusos mitóticos não se formam corretamente e não são capazes de segregar os cromossomos, e assim não permitem que as células se dividam, levando-as a morte celular. Dentre estas drogas podemos citar a colchicina e a vincristina, ambas isoladas inicialmente de plantas e hoje produzidas sinteticamente.
Filamentos de actina
Os filamentos de actina – ou microfilamentos – são formados por duas fitas entrelaçadas em hélice com 5 a 9 nm de diâmetro, sendo os mais finos filamentos do citoesqueleto. São flexíveis, mais frágeis e em geral menos longos que os microtúbulos. Eles não possuem um ponto de origem comum – como o centrossomo no caso dos microtúbulos – e podem estar distribuídos por todo o citossol. Porém, muitas vezes se concentram na periferia celular, próximos à membrana plasmática.
Dentre as funções dos filamentos de actina podemos citar a determinação da forma celular, a formação de estruturas envolvidas na migração celular, a formação de microvilosidades, a participação na contração muscular e a formação do anel contrátil ao final da citocinese.
Todos os microfilamentos são constituídos de moléculas de actina presentes em todas as células eucarióticas e geralmente codificadas por vários genes muito conservados nos diferentes organismos. Apesar da grande similaridade entre as sequencias primárias da actina em diferentes organismos, as poucas diferenças podem refletir grandes mudanças nas propriedades estruturais da proteína. Devido a essas diferenças, em vertebrados são encontradas 3 diferentes actinas – α, β e ƴ – sendo que a α-actina está presente em células musculares.
Todas as actinas são proteínas globulares que possuem um sítio de ligação a uma molécula de ATP. Após a sua tradução encontram-se monoméricas livres no citossol, chamados de actina-G. O início da polimerização dos filamentos de actina ainda vem sendo estudada, mas estudos indicam que ela ocorre a partir de trímeros de actina que são formados com auxílio de proteínas regulatórias, já que a reação para a formação destes trímeros é desfavorável. Já a adição de moléculas de actina a esses trímeros é favorável e não necessita de auxílio de outras proteínas, e quando uma molécula é incorporada ao filamento ela é chamada de actina-F.
Assim como os microtúbulos os filamentos de actina são polarizados, possuindo uma extremidade mais e uma extremidade menos. Ambas as extremidades estão sujeitas a polimerização e despolimerização, porém na subunidade mais essas reações ocorrem de forma mais rápida.
Quando uma actina se liga a um filamento a molécula de ATP rapidamente se hidrolisa a ADP, e a subunidade tende a se dissociar do filamento. De maneira muito similar ao que ocorre nos microtúbulos, se adição de moléculas de actina ao filamento é mais rápida que a hidrólise do ATP e o consequente desligamento da subunidade do filamento, o filamento irá crescer já que novas moléculas ligadas a ATP serão adicionadas a extremidade do filamento mantendo o chamado quepe de ATP. No caso contrário, quando a hidrólise do ATP é mais rápida que a adição de novas moléculas ocorre do encurtamento do filamento, já que o quepe de ATP é perdido.
A formação dos filamentos de actina envolve uma fase chamada de nucleação, quando os filamentos são formados e crescem de maneira rápida, e uma fase em que os filamentos são mantidos com tamanho estável, chamada de fase de equilíbrio. Neste momento, novos monômeros estão sendo incorporados ao filamento, porém em proporção semelhante ao conjunto de monômeros que se desliga do filamento. O filamento se mantem do mesmo tamanho mesmo com o fluxo de troca constante das subunidades. Esse fenômeno é chamado de treadmilling.
Diversas proteínas acessórias aos filamentos de actina foram descritas, e são responsáveis por regular a formação e proporcionar arranjos bidimensionais e tridimensionais dos filamentos. Em relação a regulação da formação dos filamentos de actina podemos citar a profilina que se liga a subunidades livres de actina e favorece a ligação das subunidades aos filamentos, elongando-os, e a thimosina que tem a ação contrária, se ligando as subunidades e preve que estas se liguem aos filamentos. Sobre os filamentos formados podem atuar a cofilina, que acelera o encurtamento do filamento, e a tropomiosina, que estabiliza os filamentos. Outras proteínas ainda podem clivar os filamentos, como a gelsolina, que cliva os filamentos e se mantem ligada à extremidade mais dos mesmos.
Os filamentos já formados podem se organizar em feixes longos e paralelos, ou em redes/tramas bi e tridimensionais. As proteínas responsáveis por organizar os filamentos nessas estruturas são divididas em duas classes: as proteínas formadoras de feixes e as proteínas formadoras de géis. Um exemplo de proteína pertencente a primeira classe é a formina, que regula a formação de filamentos se ligando a extremidade mais dos filamentos em crescimento, e ainda favorecem a formação de filamentos longos que interagem formando feixes. Dentro dessa classe também podemos citar a fimbrina, fascina e a alpha-actinina, que se ligam aos filamentos já formados e os organizam paralelamente, formando feixes maiores e mais resistentes. Já na classe das proteínas que formam redes ou géis, os complexos ARP auxiliam a nucleação de microfilamentos perpendiculares a filamentos já existentes, propiciando a formação de redes. As filaminas também são capazes de conectar filamentos já existentes formando redes.
A estabilização destas redes e feixes próximos à membrana plasmática é mediada pela espectrina, proteína que liga os filamentos as membranas, posicionando-os próximos a membrana e mantendo a sua organização espacial. Essas redes e feixes de filamentos normalmente são formadas próximas à membrana plasmática ou em estruturas especializadas, como no caso das microvilosidades, filopódios e lamelipódios. Geralmente essas estruturas são formadas em resposta a fatores externos e necessitam de uma rápida mudança na organização dos filamentos. As microvilosidades são protrusões da membrana plasmática em forma de dedos. Estão presentes em células epiteliais e aumentam drasticamente a área de superfície celular. Por exemplo, células epiteliais do intestino apresentam milhares de microvilosidades que aumentam a superfície de contato com o meio extracelular e sua capacidade de absorver moléculas. As microvilosidades são formadas filamentos de actina organizados paralelamente com auxílio de proteínas acessórias fimbrina ou villina, formando feixes de filamentos que são conectados à membrana plasmática com auxílio de outras proteínas como a calmodulina e miosina I. Esses filamentos na base da microvilosidade conectam-se à rede de filamentos no citossol.
Já os lamelipódios, filopódios e pseudopódios estão relacionados à migração celular. A migração de células sobre um substrato envolve ciclos de formação de protrusões da membrana em uma extremidade da célula, levando à tensão de todo o córtex celular, a ligação destas protrusões ao substrato, e enfim a tração de todo o corpo celular em direção a extremidade onde se formaram as protrusões, aliviando a tensão gerada e promovendo o deslocamento da célula. Dependendo do tipo celular são encontrados diferentes tipos de protrusões, chamadas de lamelipódios, filopódios e pseudopódios. Todos são formados por filamentos de actina, mas a organização destes é diferente: nos filopódios os filamentos estão organizados em uma dimensão, nos lamelipódios em duas dimensões e nos pseudopódios em três dimensões. O ancoramento destas protrusões ao substrato também envolve microfilamentos pois é mediado por proteínas transmembranares chamadas integrinas, que se ligam no meio extracelular à elementos do substrato e dentro da célula se conectam aos microfilamentos.
Outra estrutura transiente formada por actina que demonstra a grande plasticidade destes filamentos é o anel contrátil. O anel se forma durante a citocinese, etapa da mitose quando ocorre a separação das duas células filhas. O anel tem a função de contrair e assim estreitar a ponte intercelular e aproximar a membranas, facilitando a ruptura das mesmas.
Outra função muito importante das células que envolvem filamentos de actina é a contração muscular. As células musculares tem seu citoplasma repleto de filamentos de actina associados a proteínas acessórias motoras. A primeira proteína motora identificada foi em células de tecido muscular esquelético e foi chamada de miosina. Hoje ela é chamada de miosina II, uma vez que diversas outras miosinas foram descobertas. Todas as proteínas motoras relacionadas a filamentos de actina são da superfamília das miosinas, sendo distribuídas em diversas subfamílias. Todas elas possuem um domínio motor relativamente conservado, e caudas C- e N-terminais variadas. O N- terminal forma cabeças que possuem afinidade pelos filamentos de actina, e as caudas interagem com outros elementos, sendo que a diversidade das caudas reflete a diversidade de elementos que se ligam a estas proteínas. Elas podem carregar vesículas, organelas, se ligar a membrana e a outros elementos que participam de estruturas ricas em actina, como microvilosidades e miofribrilas.
Nos músculos esqueléticos as células são repletas de filamentos de actina organizados que formam as chamadas miofibrilas: cilindros de 1-2 µm de diâmetro e abrigam repetições das unidades contráteis das células, os sarcômeros. Os sarcômeros são formados por filamentos de actina e miosina organizados, chegam a 2,2 µm de comprimento, e a repetição destes confere a aparência estriada dos músculos uma vez que podemos observar bandas claras e escuras nos sarcômeros.
Quando observados por microscopia eletrônica de transmissão é possível observar as bandas claras e escuras dos sarcômeros, e ainda filamentos finos e grossos. Cada sarcômero é formado por discos Z na sua lateral, onde se ancoram os filamentos finos. No centro do sarcômero está a banda escura, formada pelos filamentos grossos, e no centro da banda escura podemos observar a linha M. As bandas claras possuem então no seu centro os discos Z, e abrigam os filamentos finos de dois sarcômeros adjacentes.
Os filamentos finos são formados por filamentos de actina associados a algumas proteínas, e os filamentos grossos são formados por miosinas. Como já descrito os filamentos de actina estão alinhados pois todos têm sua extremidade mais ancorada no disco Z. As extremidades menos se direcionam para o centro do sarcômero e se sobrepõe as extremidades dos filamentos grossos. Já as moléculas de miosina estão conectadas entre si, e o ponto de conexão forma a linha M. A contração muscular ocorre quando as moléculas de miosina caminham sobre os filamentos de actina, se direcionando para a extremidade mais. Assim, os filamentos de actina e miosina se sobrepõem e ocorre o encurtamento do sarcômero, levando a contração muscular. Esse movimento é dependente de ATP, que quando hidrolisado a ADP gera a energia necessária à contração, e também é dependente de cálcio, que é o sinal inicial necessário à contração.
