Isaias Cavalcante de Oliveira
Introdução
A microscopia confocal consiste em uma série de técnicas em microscopia que permitem que a quantidade de luz incidida e recebida em uma amostra sejam controladas, ou seja, é possível limitar (eliminar ou reduzir) luz de fundo fora do plano focal – que geralmente causa distorções e/ou alterações na imagem. Além disso, oferece melhor controle da profundidade de campo e a coleta de secções ópticas seriais de estruturas celulares ou amostras mais grossas, permitindo a construção da imagem em diferentes dimensões. Possui uma ampla aplicabilidade em diversas áreas como biologia, medicina, engenharia e outras.
História
O primeiro projeto foi idealizado na década de 1950 por Marvin Minsky – cientista norte-americano – quando estudava neurônios do sistema nervoso central. Minsky tinha dificuldades em visualizá-los tridimensionalmente devido à complexidade do arranjo das células no cérebro e porque a iluminação de um volume relativamente grande de material levava ao aumento do espalhamento da luz utilizada. Em suas ideias, um microscópio ideal deveria iluminar cada ponto da amostra isoladamente e medir a quantidade de luz espalhada ou absorvida por aquele ponto de modo a não permitir o “excesso” de luz advindo de outros planos da amostra. Isso porque em muitos microscópios (ópticos e de campo claro, por exemplo) toda a amostra é iluminada, e a imagem resultante é a soma de todos os planos iluminados. Em amostras mais espessas, onde a lente objetiva não tem profundidade de foco suficiente, a luz dos planos de amostra acima e abaixo do plano focal também é detectada. Também, em microscopia de fluorescência, qualquer molécula de corante no campo de visão será estimulada, inclusive aquelas em planos fora de foco. Tais efeitos negativos sobre a imagem aumentam quando são usadas objetivas de grande aumento e profundidade de campo limitada. Desse modo, a luz fora de foco causa um desfoque à imagem final, reduzindo a sua resolução. Foi com base nessas ideias que Minsky “deu a luz” (com direito a um trocadilho) à confocalidade. Outros grandes pesquisadores que contribuíram com as técnicas atuais utilizadas em conjunto para produzir imagens nítidas de estruturas celulares e subcelulares incluem Goldmann, Zyun Koana e Hiroto Naora, David Egger e Paul Davidovits, etc.
Afinal, o que determina então que um microscópio seja “confocal”?
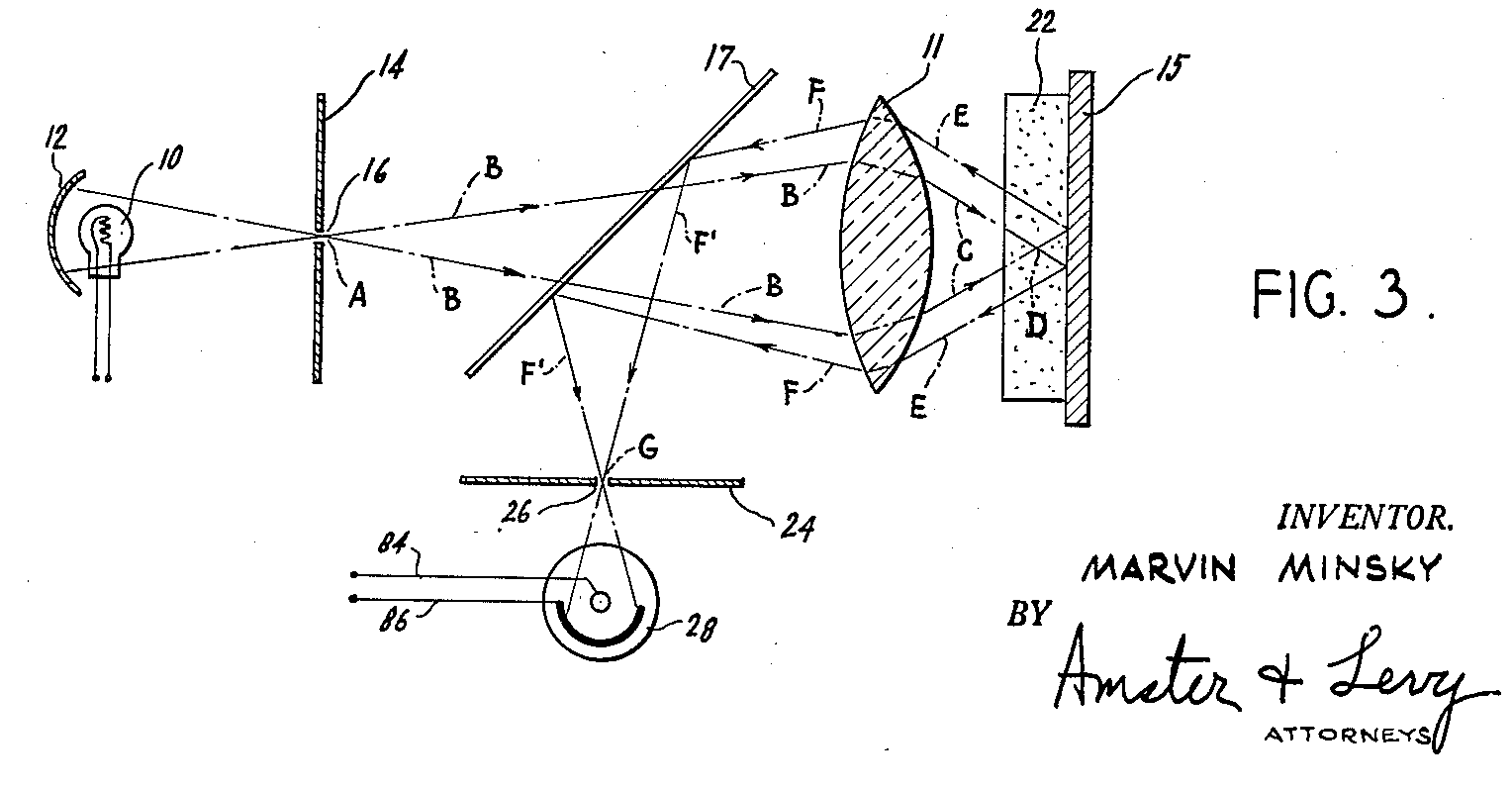
Figura 1 – Protótipo do microscópio confocal, patenteado por Marvin Minsky (7 Novembro de 1957).
Imagem em domínio público, de: https://commons.wikimedia.org/wiki/File:Minsky_Confocal_Reflection_Microscope.png
Funcionamento
Em um microscópio de fluorescência convencional (de campo amplo), toda a amostra é uniformemente iluminada a partir de uma fonte de luz. Todas as partes da amostra podem ser excitadas ao mesmo tempo e a fluorescência resultante é detectada pelo fotodetector ou câmera do microscópio. Diferentemente, o microscópio confocal usa um sistema de iluminação pontual, onde cada parte da amostra é iluminada individualmente, e o excesso de luz é bloqueado por um pequeno disco metálico com um orifício no centro (chamado de pinhole).
Um pinhole é colocado na frente de uma fonte de luz, geralmente laser de íons de argônio, hélio-neônio, zircônio, para fornecer um ponto de luz focado na amostra por uma lente objetiva. Outro pinhole fica em um plano opticamente alinhado na frente do detector eliminando o sinal fora de foco e assim a imagem é formada apenas por fótons (pacotes de luz) que se encontram no ponto focal da objetiva, daí surge a ideia de confocalidade. A partir da observação e armazenamento de cada ponto separadamente, uma varredura regular na amostra (nos eixos X e Y), é reconstruída a imagem final. Com a varredura, pode-se dividir a imagem em “fatias sucessivas” que compõem o eixo Z (profundidade), que sendo processado pode criar uma imagem tridimensional. Em geral, o detector (fotodetector) é um fotomultiplicador ou um fotodiodo (dispositivo semicondutor que converte luz em corrente elétrica) altamente sensível e o sinal elétrico no fotomultiplicador é digitalizado e processado por um programa em um computador. A resolução alcançada é dada pela abertura numérica (NA) da lente objetiva – a quantidade de luz que efetivamente penetra na objetiva, pelas propriedades da amostra (índice de refração) e pelo comprimento de onda da luz. O microscópio oferece boa qualidade na resolução lateral e axial devido aos pequenos diâmetros dos orifícios e alta abertura numérica da lente objetiva, e tem uma profundidade de campo relativamente estreita. Outros equipamentos incluem também espelhos de varredura rápida, filtros para seleção de comprimento de onda e outros tipos de iluminação a laser. Veja a ilustração abaixo.
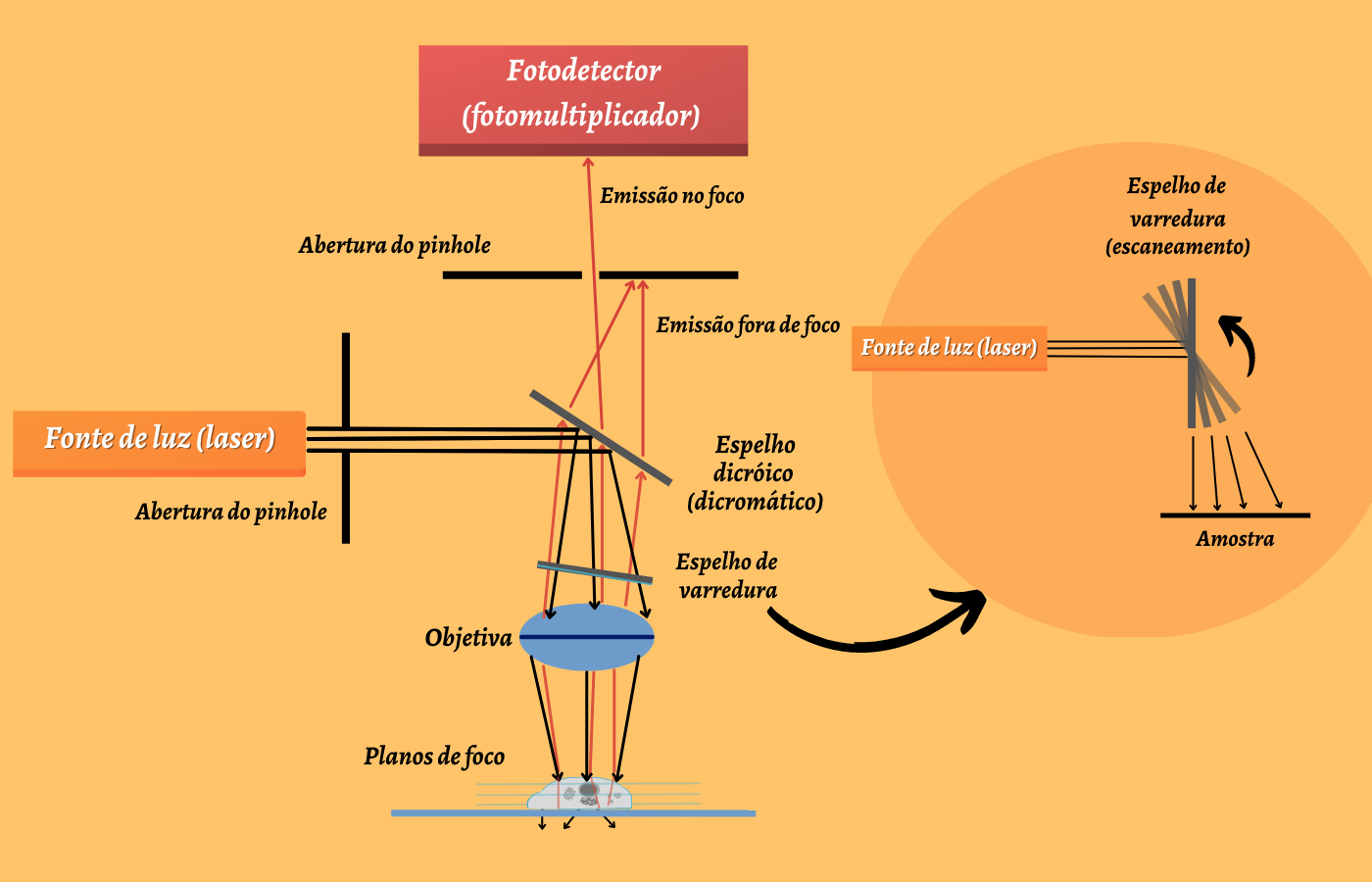
Figura 2 – Funcionamento do microscópio confocal (Baseado em ELLIOTT, 2019). A luz de uma fonte (preto) é passada através de um orifício para um espelho dicromático (espelho dicroico) que funciona como um filtro de cores, selecionando a luz que passa em uma pequena faixa de cores e refletindo a luz de uma cor determinada. Essa luz é refletida para a lente objetiva que foca o feixe em um ponto na amostra. Os espelhos de varredura varrem o feixe de excitação sobre a amostra ponto por ponto para construir a imagem. A fluorescência emitida (aqui em vermelho) passa de volta pela lente objetiva, o espelho dicromático e é detectada pelo fotodetector. Outro orifício colocado no plano da imagem alinhada ao ponto focal na amostra serve para rejeitar a luz fora de foco, que não é captada pelo detector. Em detalhe, há um esquema do funcionamento dos espelhos de varredura que varrem a luz de excitação através da amostra.
(Crédito: Isaias Cavalcante de Oliveira)
Outras descobertas
Muitos avanços foram surgindo com o passar do tempo nas diferentes áreas da informática, microeletrônica, óptica e biociências. Nesse período, surgiram várias fontes de luz laser, algoritmos que permitiam a manipulação de imagens digitais tornavam-se cada vez mais sofisticados e fáceis de usar, além de um notável aprofundamento no entendimento de diferentes estruturas celulares. Uma dessas importantes descobertas foi a de Albert H. Coons e seus colaboradores, em 1941, onde descreveram a conjugação de um agente fluorescente a um anticorpo dando origem a imunofluorescência e seus desdobramentos. Desse modo, é possível acoplar corantes fluorescentes a moléculas de anticorpos, que então servem como reagentes para coloração, ligando-se de forma muito seletiva a determinadas macromoléculas as quais eles reconhecem nas células ou na matriz extracelular. Entre os exemplos podemos citar a fluoresceína, que emite uma fluorescência verde intensa quando excitada com luz azul, e a rodamina, que emite uma fluorescência vermelha quando excitada com luz amarelo-esverdeada. Outros corantes mais novos incluem Cy3®, Cy5® e Alexa®, nanopartículas fluorescentes ou quantum dots (nanocristais semicondutores), etc. Os microscópios confocais começaram a se tornarem populares a partir de 1987, sendo amplamente utilizados para analisar amostras contendo marcadores fluorescentes.
Também na década de 60, uma “brilhante” descoberta foi realizada por Osamu Shimomura que isolou a proteína verde fluorescente (green fluorescent protein ou GFP, naturalmente produzida pelo cnidário Aequorea victoria (uma hidromedusa comum no pacífico norte) que emite fluorescência no comprimento da onda luminosa do verde no espectro de luz visível). Ainda, Frank Johnson isolou uma proteína bioluminescente cálcio-dependente, que denominou aequorina, nome derivado do cnidário com que trabalhava e Douglas Prasher em 1987 foi o responsável pelo reconhecimento da comunidade científica do potencial da GFP como gene repórter. Martin Chalfie e seu grupo em seus experimentos conseguiram expressar a GFP (seu gene) em outros organismos transferindo o gene da GFP para o nematódeo Caenorhabditis elegans e a bactéria Escherichia coli. O gene é usado na produção de proteínas de fusão, constituídas por um gene de interesse fundido com o da GFP. Essa técnica é conhecida como gene repórter fluorescente, e passou a permitir, por exemplo, o monitoramento da localização de proteínas alvo in vivo. Shimomura, juntamente com Martin Chalfie e Roger Y. Tsien recebeu o Prêmio Nobel de Química em 2008.
Tipos: Vantagens x desvantagens
Microscópios Confocais de Varredura a Laser
Provavelmente o mais comum, o microscópio confocal de varredura a laser (LSCM, no inglês), possui como fonte de luz um feixe de laser que varre a amostra por meio de alguns espelhos de varredura – frequentemente um par de espelhos associados a um dispositivo piezoelétrico ou um galvanômetro – varrendo o feixe nas direções X e Y em um determinado campo de visão. Depois, toda a amostra também é varrida para produzir uma imagem da secção óptica ou corte. Para obter o eixo Z altera-se o ponto focal e o processo de varredura é repetido na nova fatia. No equipamento, é possível variar o tamanho do orifício alterando a quantidade de luz coletada e também a espessura da seção óptica. Assim a imagem é construída a partir das secções coletadas e além das imagens 2D e 3D (x, y, z), com auxílio de certos detectores espectrais e controle de sombreamento podem ser criadas imagens 4D (x, y, z, t) e até 5D (x, y, z, t, λ). Esse processo geralmente é lento e usado para criar imagens de alta resolução de amostras fixas, porém em equipamentos mais modernos funcionam também para amostras vivas.
Microscópios confocais de disco giratório
Neste caso, os microscópios confocais utilizam um sistema de varredura multiponto, ou seja, uma série de orifícios móveis em um disco para escanear pontos de luz. Esse pequeno disco de metal é chamado de “disco de Nipkow” em referência a seu idealizador Paul Nipkow na década de 1880. Os orifícios são posicionados de forma que diversas partes da amostra sejam varridas conforme o disco gira. Assim, a luz de cada ponto é eletricamente transmitida e remontada remotamente por meio de um segundo disco, reduzindo a energia de excitação necessária para iluminar uma amostra quando comparado aos microscópios de varredura a laser. A imagem geralmente é capturada por uma câmera de dispositivo de carga acoplada (CCD). De modo simples, secções diferentes do CCD geram cargas elétricas de maneira proporcional à intensidade da luz percebida por elas e estas cargas são medidas e organizadas formando uma imagem gravada no sistema de memória da câmera. Tais microscópios apresentam como vantagem também a velocidade e o fato da amostra não precisar ser movida através da iluminação e sim o disco. Porém o orifício não é ajustável, e vem em tamanhos correspondentes à lente objetiva usada, além da desvantagem em relação sincronização da velocidade da câmera e velocidade do disco.
Equipamentos mais modernos possuem um segundo disco giratório com uma série de microlentes e este é colocado antes do disco giratório contendo os orifícios. Cada pinhole tem uma microlente associada que atuam capturando uma ampla faixa de luz e direcionando-as em cada orifício, e reduzindo a quantidade de luz bloqueada pelo disco giratório.
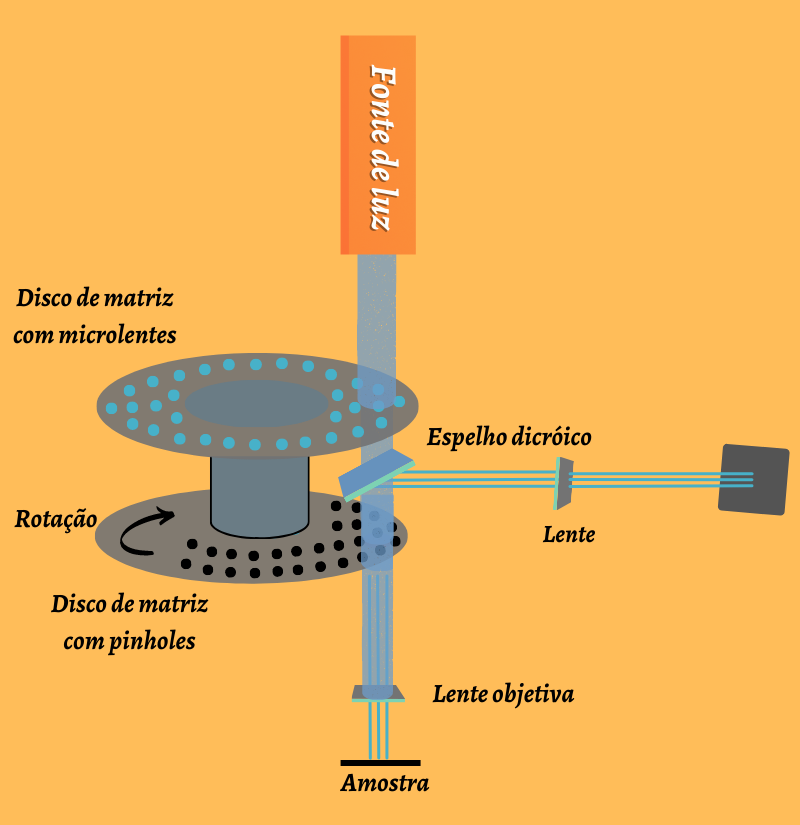
Figura 3 – Funcionamento simplificado do microscópio confocal de discos giratórios (Baseado na linha IXplore SpinSR®, Olympus®). A luz de uma fonte (azul) passa através de um disco com microlentes para um espelho dicromático (espelho dicróico), e depois para um segundo disco com muitos orifícios (pinholes). Essa luz é refletida para a lente objetiva que foca o feixe em um ponto na amostra. A fluorescência emitida passa de volta pela lente objetiva, o espelho dicromático e é detectada na maioria dos casos por uma câmera.
(Crédito: Isaias Cavalcante de Oliveira)
Microscópios confocais de varredura híbridos
Outros microscópios tentam misturar características entre os monopontuais e multipontuais. Um deles é o confocal de varredura de fenda, que ao invés do orifício redondo possui uma fenda retangular para rejeitar a luz fora de foco. Como vantagem cobre mais da amostra em um campo de visão e aumenta significativamente a velocidade de aquisição de imagem, porém trabalha com uma resolução mais baixa e fotobranqueamento (ou apagamento) – perda de fluorescência por fotodegradação – rápido. Já em um microscópio confocal de campo varrido (SFC – Swept Field Confocal) as aberturas permanecem imóveis e o que se move são os espelhos que varrem a amostra. Os fótons emitidos são direcionados através de um conjunto complementar de orifícios ou fendas para uma câmera CCD. Apresentam velocidade, aumento na eficiência da coleta de luz e a redução de efeitos indesejáveis na imagem devido ao movimento das aberturas.
Por fim, há os microscópios de matriz programável (PAM), que possuem um conjunto de orifícios móveis e controles eletrônicos dedicados. Este equipamento utiliza uma matriz de pixels que é capaz de ajustar os pixels gerados na imagem observada, como opacidade e refletividade. A imagem também é formada por uma câmera CCD.
Considerações Finais: Usos
A microscopia confocal apresenta grande versatilidade e possui muitas aplicações. Como exemplos envolvendo o organismo modelo Drosophila melanogaster, a mosca das frutas, há estudos envolvendo o acompanhamento da atividade de cálcio muscular durante a locomoção de larvas, ou no ovário de Drosophila – que constitui um modelo in vivo importante para se estudar células-tronco germinativas (GSC) e também doenças neurodegenerativas. Em plantas, a microscopia confocal é utilizada no estudo de interações planta-patógeno, em anatomia de órgãos e tecidos e no acompanhamento do tráfego de moléculas. Também, a técnica é usada na avaliação de várias doenças, como doenças da córnea, na em casos de ceratomicose e análise celular na córnea normal, pós-cirúrgica e doente, endoscopia (endomicroscopia), na indústria farmacêutica, no estudo de biofilmes – estruturas porosas complexas, envolvidas por uma matriz (açúcares) onde vivem microrganismos – observando sua estrutura em diferentes escalas. Na visualização 3D da microestrutura do mármore e materiais de construção fornecendo importantes informações sobre características microestruturais e propriedades de rochas. Na determinação da idade de artefatos e muitos outros.
Como limitação apresentam um número limitado de comprimentos de onda de excitação disponíveis para os sistemas de iluminação a laser e dependendo da intensidade da emissão laser podem haver danos fotoquímicos nos marcadores fluorescentes acelerando o seu decaimento. Mesmo sendo melhores para visualizar amostras mais grossas os microscópios confocais podem obter imagens somente até uma profundidade de aproximadamente de 150 µm. Considera-se ainda o alto custo desses equipamentos limitando a sua aquisição para laboratórios de pequeno porte e tornando seu acesso mais dificultado.
Veja algumas imagens abaixo.
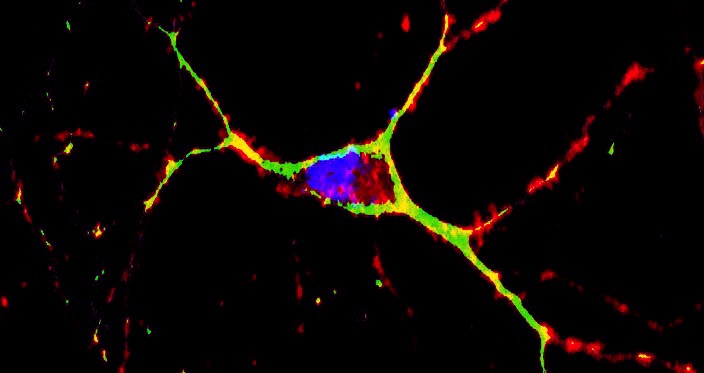
Figura 4 – Imagem de microscopia confocal de um neurônio de camundongo isolado vivo corado para DNA (núcleo em azul, marcado com DAPI®) e mitocôndrias (mitotracker, vermelho e o antioxidante sintético XJB-5-131® marcado com BODIPY® marcado – verde). A imagem provém de experimentos examinando o dano oxidativo e a disfunção mitocondrial em relação ao envelhecimento e doenças neurodegenerativas relacionadas à idade, incluindo a doença de Huntington. Imagem em domínio público. Ref: https://doi:10.7295/W9CIL44101 | CIL:44101. Para saber mais confira o artigo: http://dx.doi.org/10.1016/j.celrep.2012.10.001
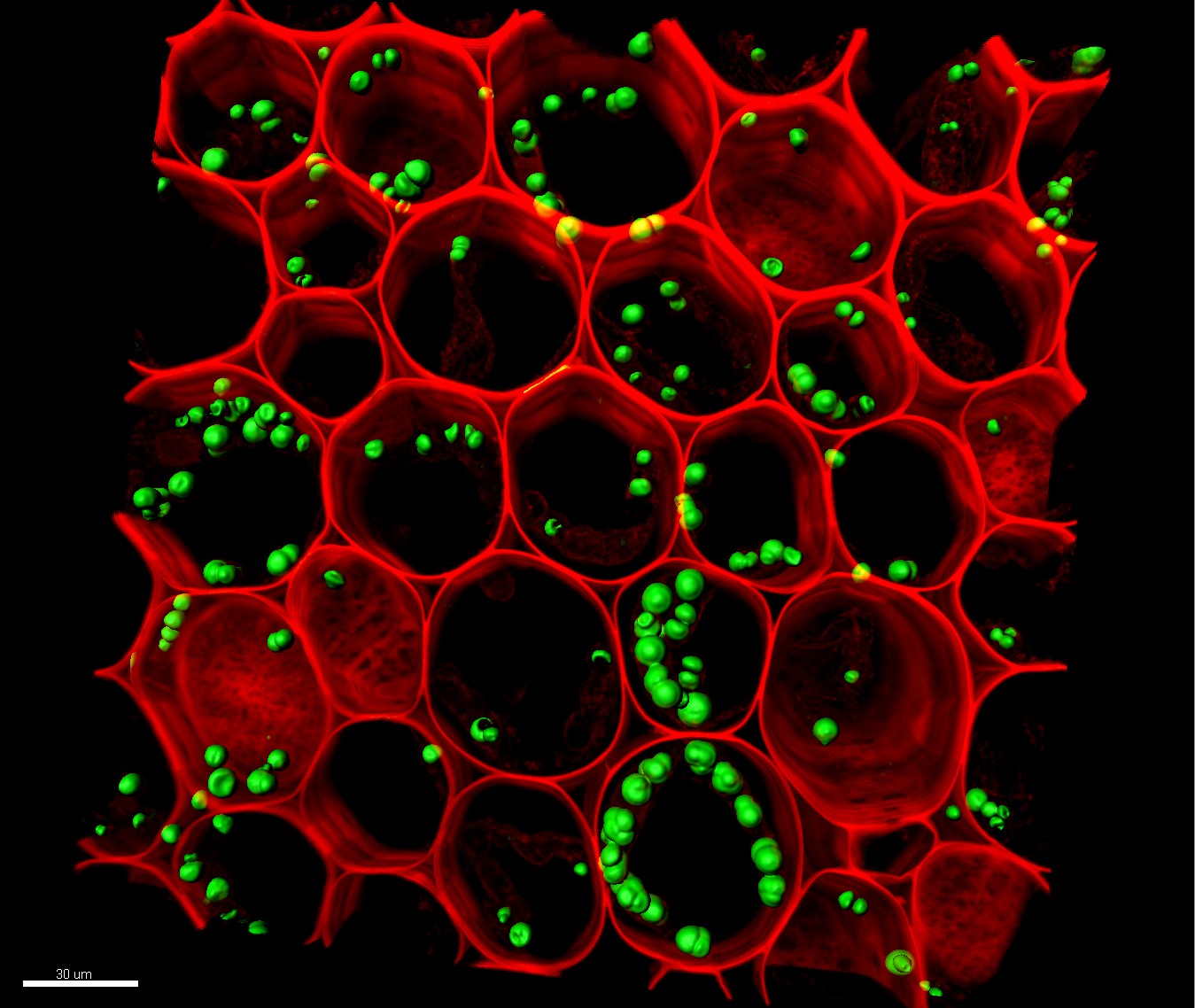
Figura 5 – Imagem 3D renderizada de uma série z confocal tirada do rizoma (porção subterrânea do caule) de Convallari majalis (lírio do vale). Os objetos verdes representam cloroplastos reconstruídos; as paredes das células são mostradas em vermelho. Essa imagem foi obtida usando uma objetiva de imersão em óleo de 63x (NA 1.40) e um laser de íons de argônio/criptônio em comprimentos de onda de 488 nm e um laser de hélio/neon de 543 nm. Os perfis da série z de 30 seções ópticas foram coletados em intervalos de 1,42 micrômetros (com uma média de linha de 4 para reduzir o ruído). O eixo Z foi analisado com o software IMARIS® para ajustar cores e criar renderizações 3D de cloroplastos. Imagem sob licença CC BY-NC-SA 3.0 | Ref: https://doi:10.7295/W9CIL40405 | CIL: 40405.
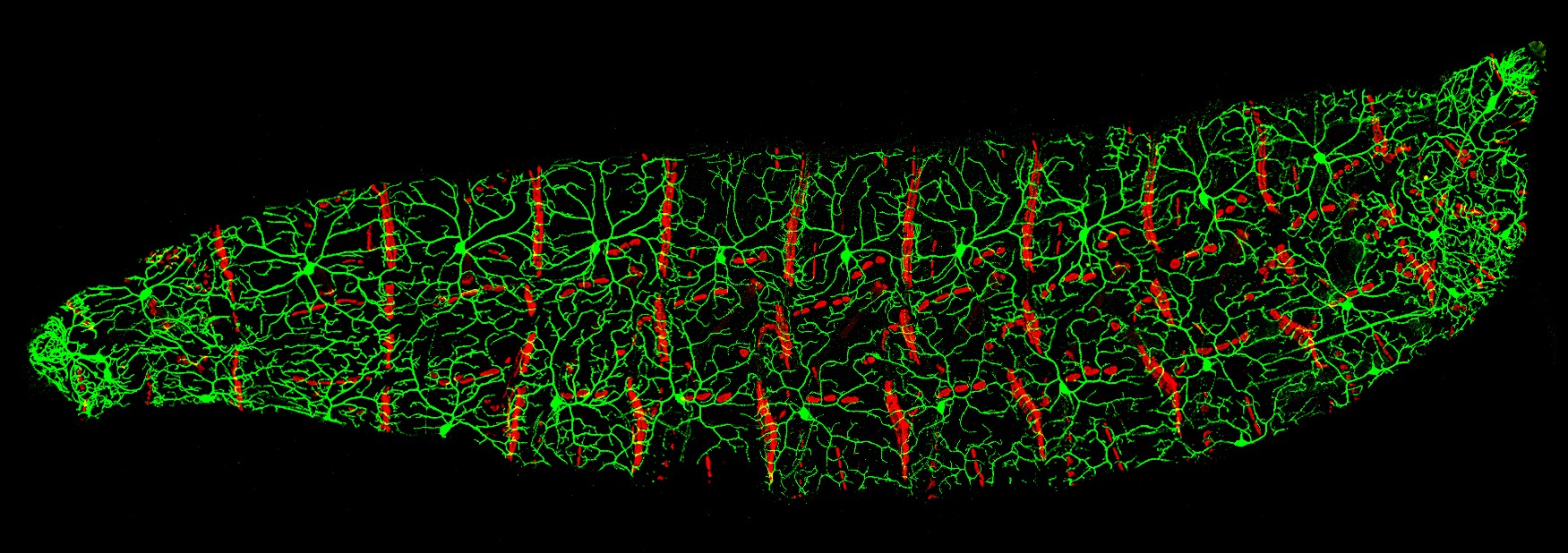
Figura 6 – Imagens confocais da larva de Drosophila (mosca da fruta) com neurônios sensoriais de arborização dendrítica marcada e células epidérmicas. O verde são os dendritos dos neurônios sensoriais na parede do corpo e o vermelho são os locais de fixação dos músculos da parede do corpo. Esta imagem faz parte de uma imagem composta de varias larvas disponível como CIL 41825. Recebeu Menção Honrosa em 2010 pela Olympus BioScapes Digital Imaging Competition®. Imagem sob licença CC BY-NC-SA 3.0 | Ref: https://doi:10.7295/W9CIL41824 | CIL: 41824.
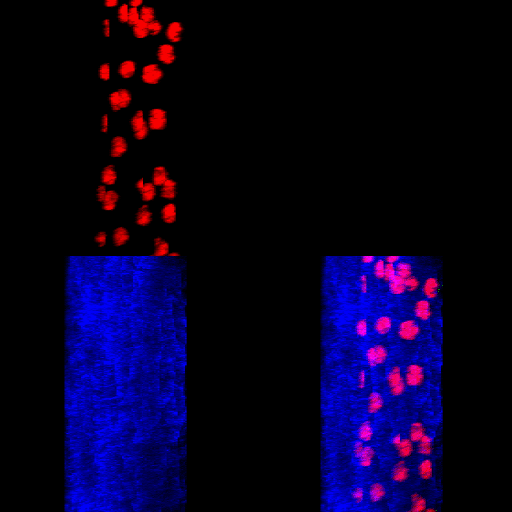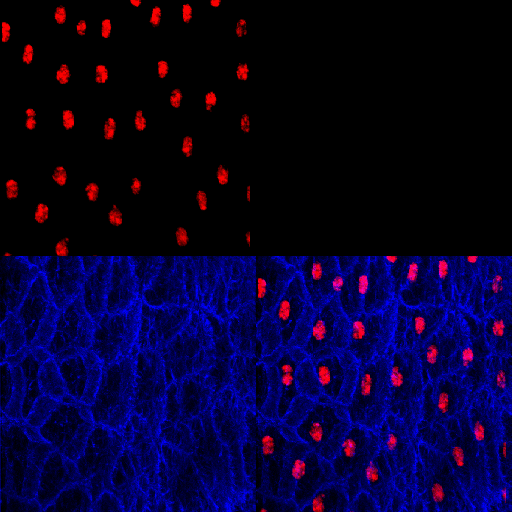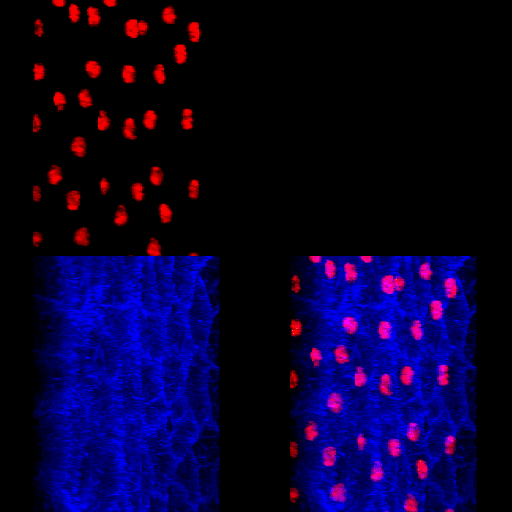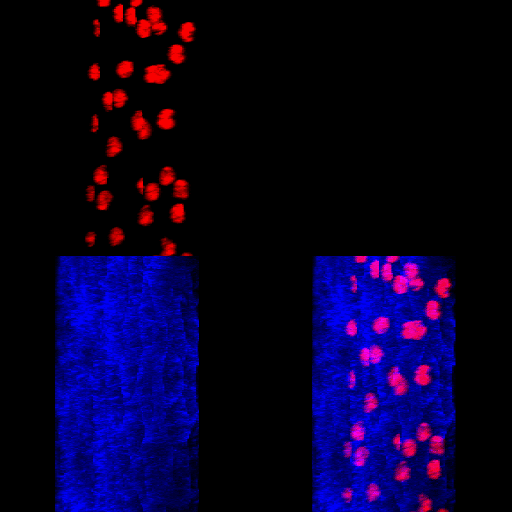
Figura 7 – Animação gerada a partir de uma reconstrução de imagens obtidas por microscopia confocal. Corpo gorduroso de Rhynchosciara americana.
Para uso offline:
Para uso em seus estudos quando não é possível conexão com a internet.
Cellzine – Microscopia Confocal (Versão resumida em PDF para impressão em uma folha A4)
Referências
ALBERTS, B. et al. 2017. Biologia Molecular da Célula. 6ª ed. Artmed
ELLIOTT, A. D. Confocal Microscopy: Principles and Modern Practices. Current Protocols in Cytometry, v. 92, n. 1, 26 dez. 2019. Disponível em: https://doi.org/10.1002/cpcy.68
CORRÊA, J. R. et al. Microscopia Confocal Básica (apostila). UFJF. Disponível em: https://www2.ufjf.br/pgcbio//files/2018/10/Apostila.pdf
MAUKO, A. et al. Use of confocal laser scanning microscopy (CLSM) for the characterization of porosity in marble. Materials Characterization, v. 60, n. 7, p. 603–609, Jul. 2009. Disponível em: https://doi.org/10.1016/j.matchar.2009.01.008
MINSKY, M. Memoir on inventing the confocal scanning microscope. Scanning, 10: 128-138, 1988. Disponível em: https://doi.org/10.1002/sca.4950100403
MONA. GFP: Conheça a história da proteína mais popular da BioMol! – Biolinker. Disponível em: https://biolinker.tech/gfp-historia/
SHALABY, N. A., & BUSZCZAK, M. Live-Cell Imaging of the Adult Drosophila Ovary Using Confocal Microscopy. Methods in molecular biology (Clifton, N.J.), 1463, 85–91, 2017. Disponível em: https://doi.org/10.1007/978-1-4939-4017-2_6
WIKIPEDIA. Confocal Microscopy. Disponível em: https://en.wikipedia.org/wiki/Confocal_microscopy
https://www.olympus-lifescience.com/pt/microscopes/inverted/ixplore-spinsr/
