Dr. Rafael Seigi Kohasigawa
Introdução
Para que um organismo multicelular seja possível deve haver comunicação entre suas células pois é necessário que elas colaborem entre si e que seu comportamento possa ser coordenado. Para que essa comunicação seja feita, há mecanismos que controlam os sinais emitidos e outros que permitem sua recepção e interpretação pela célula, a qual ajusta seu comportamento conforme as necessidades do organismo.
A comunicação é mediada por moléculas-sinal extracelulares que são recebidas por proteínas receptoras ao se ligarem a eles. Isso ativa o receptor, responsável pela acionamento de vias intracelulares de sinalização, que são compostas por pequenas moléculas sinalizadoras e proteínas sinalizadoras intracelulares. O destino final das vias são em geral proteínas efetoras (proteínas reguladoras de genes, canais iônicos, componentes de uma via metabólica ou componentes do citoesqueleto), que são alteradas quando a via está ativa e induzem uma mudança comportamental.
Neste tópico serão tratados os princípios gerais da sinalização celular, e depois as principais famílias de receptores (GPCR, RTK, etc.) e suas vias correspondentes.
Princípios gerais da comunicação celular
Moléculas-sinal e tipos de sinalização
Há centenas de tipos diferentes de moléculas-sinal (ligantes ou primeiros mensageiros): diversas proteínas, pequenos peptídeos, aminoácidos, nucleotídeos, esteroides, retinóis, derivados de ácidos graxos e gases, que podem permanecer na membrana plasmática ou ser liberados por exocitose, se forem hidrossolúveis (ambos se ligam a receptores transmembrana), ou por difusão, caso sejam lipossolúveis (que se ligam a receptores intracelulares). A ligação específica entre a molécula-sinal e o receptor da célula alvo inicia a resposta nela, embora um mesmo receptor possa aceitar mais de um tipo de molécula-sinal, desencadeando resposta distinta ou não de acordo com a natureza molecular do ligante.
Há quatro tipos de transmissão extracelular do sinal:
- Dependente de contato: as moléculas sinal permanecem na membrana da célula que as produziu, sendo menos comum do que os outros tipos de respostas cujos ligantes são secretados. Esse tipo de sinalização é muito importante no desenvolvimento embrionário e na resposta imune.
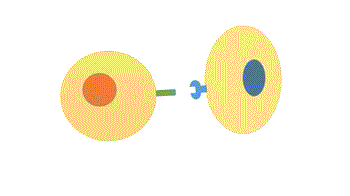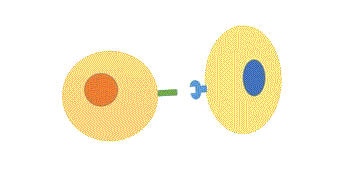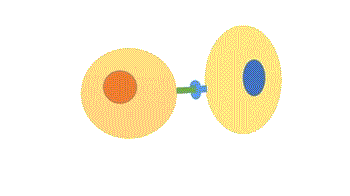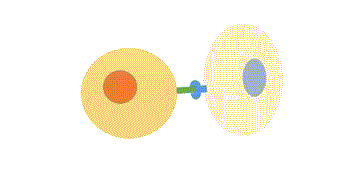
Figura 1 – Comunicação dependente de contato. (Animação: Rafael Seigi Kohasigawa)
- Parácrina: os ligantes atuam como mediadores locais, pois afetam apenas células próximas da célula sinalizadora. Os tipos celulares da célula alvo e sinalizadora em geral são diferentes, mas podem ser o mesmo, o que permite a sinalização autócrina, muito comum em células cancerosas. Há mecanismos para que a sinalização seja restrita, como rápida captação pelas células vizinhas, quebra por enzimas extracelulares, imobilização pela matriz extracelular, ação de proteína antagonistas (se ligam ao receptor ou ao ligante, impedindo a sinalização).
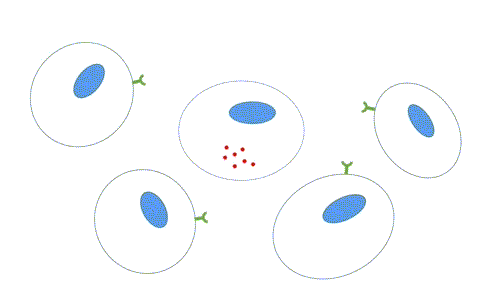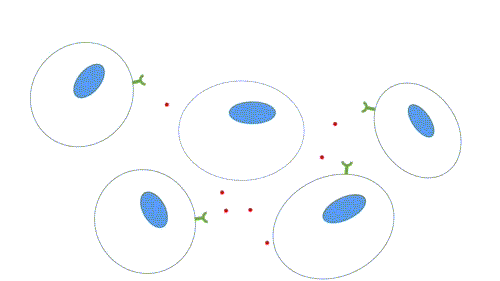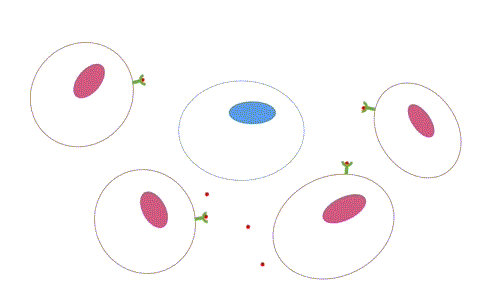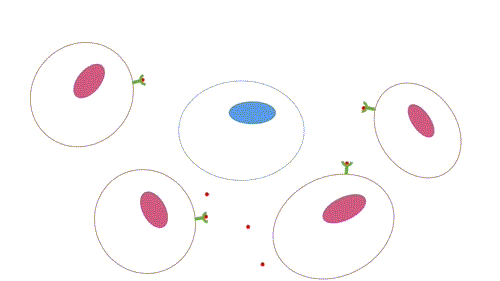
Figura 2 – Comunicação parácrina. (Animação: Rafael Seigi Kohasigawa)
- Endócrina: de longo alcance, possui transmissão lenta em relação a sinalização sináptica, já que depende da difusão e do fluxo sanguíneo, e por isso atua em concentrações muito baixas e a persistência da sinalização é maior do que a sinalização sináptica.
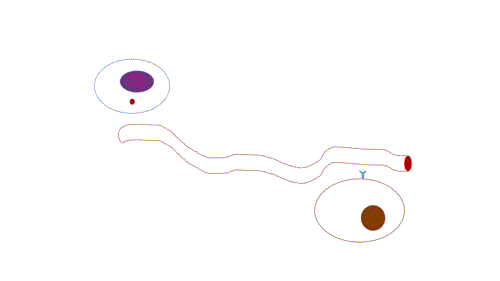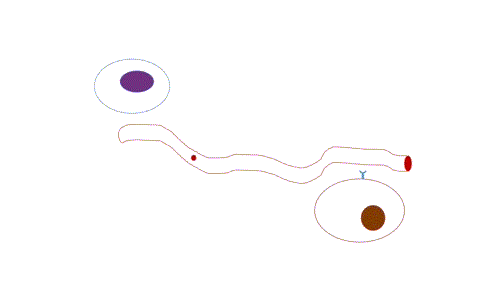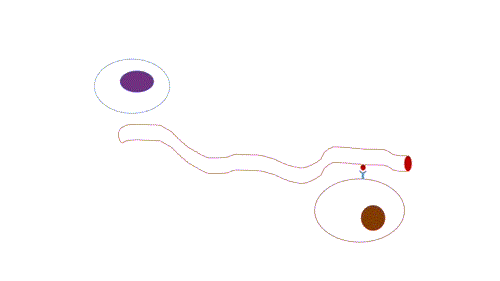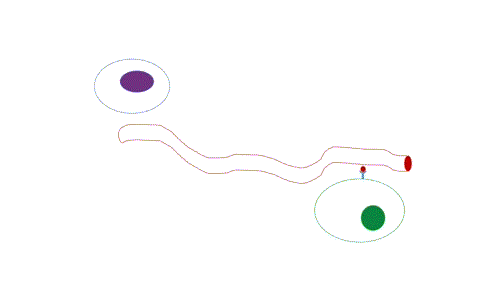
Figura 3 – Comunicação endócrina. (Animação: Rafael Seigi Kohasigawa)
- Sináptica: também de longo alcance, mas com transmissão do sinal muito mais rápida e precisa, já que o axônio atinge diretamente a célula alvo, liberando a molécula-sinal (neurotransmissor) apenas na sinapse, pequeno espaço entre o terminal sináptico e a célula alvo. Graças a isso, neurotransmissores podem alcançar grandes concentrações locais e podem ser removido rapidamente da fenda pela ação de enzimas ou proteínas transportadoras.

Figura 4 – Comunicação sináptica.
A velocidade da resposta depende do modo de liberação do sinal e da natureza da mudança comportamental que o sinal induz: mudanças em proteínas ocorrem muito rapidamente, já mudanças na expressão gênica podem demorar minutos ou horas.
Outro fator que aumenta a rapidez da propagação do sinal é a presença de junções comunicantes. Elas conectam o citoplasma de células adjacentes, permitindo a troca pequenas moléculas hidrossolúveis, em geral em ambas as direções. Isso torna homogêneas as concentrações dessas moléculas nas células envolvidas e permite a propagação do efeito de sinais que atuem por pequenos mediadores, como Ca2+ e cAMP.
Relevância Clínica
A presença de junções comunicantes é muito útil para sinalização sináptica, pois é possível que nem todas as células de um tecido tenham inervação, como de fato ocorre em hepatócitos. A queda da glicemia provoca liberação de noradrenalina no fígado, o que provoca a degradação do glicogênio em resposta ao aumento do cAMP. Entretanto, nem todos os hepatócitos tem inervação simpática, e é por meio dessas junções que essas células tem seu nível de cAMP aumentado e respondem da mesma forma que os outros hepatócitos.
Respostas à sinalização
Diferentes tipos celulares respondem de forma diferente entre si aos mesmos sinais, característica que é desenvolvida com o processo de especialização de cada célula. As combinações de sinais são quase ilimitadas e por isso permitem o controle de diversos efeitos específicos, como diferenciação, proliferação e mesmo a sobrevivência ou a morte da célula. Por exemplo, os conjuntos de sinais fazem com que as células estejam restritas a um ambiente específico, pois diferentes células exigem diferentes combinações de sinais para sua sobrevivência.
A diferença da resposta aos sinais extracelulares além de ser causada pelos receptores, também ocorre devido a maquinaria celular (diferença na ativação de proteínas sinalizadoras intracelulares, de proteínas efetoras ou de genes), logo, um mesmo ligante tem efeitos distintos sobre tipos celulares distintos. Apenas o sinal extracelular não nos indica que efeitos poderão ocorrer nas células, já que ele apenas faz com que a célula reaja de acordo com seu desenvolvimento e genes expressos.
O mesmo sinal pode provocar também diferentes efeitos de acordo com sua concentração, pois o número de receptores ativados aumenta, logo, também aumenta a concentração ou a atividade de proteínas reguladoras gênicas, o que resulta em diferenças no padrão de expressão gênica. Isso é muito importante, por exemplo, durante o desenvolvimento, por causa do gradiente de concentração de morfógenos (ligantes que atuam durante o desenvolvimento) as células tomam rumos distintos.
A velocidade com que a célula responde a remoção de um sinal depende da velocidade com que as moléculas da via de sinalização são destruídas e repostas ou, o que é mais comum, de sua conversão da forma ativa para a inativa. Como consequência, isso também determina com que rapidez uma resposta se dá quando o sinal é emitido, por isso processos que ativam proteínas, como fosforilação e ligação de GTP a uma proteína, ocorrem de forma rápida e são continuamente revertidos.
Receptores intracelulares
Esse tipo de sinalização se dá através de moléculas hidrofóbicas, como os esteróis, ou pequenas o suficiente para atravessar a membrana, como gases, e quando chegam ao interior da célula regulam diretamente a atividade da proteína alvo.
Temos como exemplo dessa sinalização:
- Alteração da atividade de uma enzima – gás NO – o NO é produzido por uma enzima chamada óxido nítrico-sintase (NOS) a partir da desaminação de uma arginina, se difunde rapidamente para fora da célula que o sintetizou e também é degradado rapidamente (em torno de 10 segundos) pela reação com água e O2. Nas células-alvo, ele se liga à enzima guanilil-ciclase, que catalisa a síntese de cGMP (GMP cíclico), o qual é degradado por uma fosfodiesterase. Mas o NO também pode alterar a atividade de uma proteína intracelular pela nitrosilação de grupos tiol (-SH) em cisteínas específicas. Por meio dessas vias o NO possui como funções:
– Relaxar musculatura lisa, como a dos vasos sanguíneos. Nervos simpáticos liberam acetilcolina nas paredes dos vasos, a qual atua sobre eles fazendo-os liberar NO, que relaxa o vaso.
– Ajuda a combater infecções: o NO também é produzido por macrófagos e neutrófilos (ambos leucócitos) no combate de infecções.
Relevância Clínica
Nitroglicerina é usada no tratamento de pacientes com angina (dor que resulta do fluxo inadequado de sangue no miocárdio) por causa da ação do NO sobre os vasos. A nitroglicerina é convertida ao gás e dilata as arteríolas, diminuindo a carga de trabalho no coração, logo, sua necessidade por O2. O processo será melhor explicado em Fisiologia.
- Ativação de receptores nucleares – hormônios esteroides e tireóideos, retinóis e vitamina D – o mecanismo de ação dessas moléculas é muito semelhante entre si: elas ligam-se ao receptor nuclear e alteram sua capacidade de controle da transcrição gênica. Por serem insolúveis, essas moléculas são transportadas pela corrente sanguínea por meio de proteínas carreadoras e se dissociam delas antes de entrar na célula-alvo.
Os receptores ligam-se a sequências a adjacentes aos genes regulados pelo ligante, alguns desses receptores ficam no citosol e só após sua ativação se ligam ao DNA, outros permanecem ligados a ele. A ativação altera a estrutura do receptor, que se separa do complexo inibidor e se liga a proteínas coativadoras da transcrição, mas a ligação pode ter função inversa, inibindo a transcrição em outros casos (alguns receptores de hormônios tireóideos).
A resposta transcricional ocorre em várias etapas: resposta primária, em que o ligante ativa a transcrição de um determinado grupo de genes, cujos produtos podem inclusive ter efeito de feedback negativo; resposta secundária, ativada pelos produtos dos genes que foram ativados pela molécula-sinal, etc. Essas respostas variam de acordo com o tipo celular do alvo, com a molécula-sinal e a combinação delas, já que são necessárias algumas proteínas reguladoras para iniciar a transcrição.
Receptores de superfície celular e vias de sinalização
Há três amplas classes de receptores:
• Receptores associados a canais: esse tipo também é conhecido como receptor ionotrópico e está envolvido na sinalização sináptica, abrindo e fechando canais iônicos ao se ligar um neurotransmissor nesses receptores. Não serão tratados nesse tópico, já que foram discutidos no tópico sobre Propriedades elétricas da membrana.
• Receptores associados à proteína G (GPCR): atuam indiretamente na regulação de enzimas e canais iônicos. Eles ativam uma proteína chamada proteína trimérica de ligação a GTP (proteína G), a qual medeia a interação entre o GPCR e a proteína alvo.
• Receptores associados a enzimas: funcionam como enzimas ou estão associados a elas, sendo que a maioria deles e das proteínas associadas são cinases (quinases), como as os receptores tirosina cinase (RTK), os mais abundantes de sua classe, e os receptores de citocinas.
Há ainda receptores que não se enquadram nessas categorias (Notch, Hedgehog), mas possuem grande importância no desenvolvimento e regeneração de tecidos, eles serão tratados posteriormente neste tópico.
A maioria desse tipo de receptores transmite o sinal por meio de pequenas moléculas sinalizadoras (mediadores intracelulares pequenos, segundos mensageiros ou mensageiros secundários) e de proteínas sinalizadoras citosólicas.
Os segundos mensageiros são gerados em resposta direta a ativação do receptor ou por proteínas sinalizadoras intracelulares, e podem ser hidrossolúveis (Ca2+, cAMP), difundindo-se pelo citosol, ou lipossolúveis (diacilglicerol), difundindo-se pela membrana plasmática, transmitindo o sinal por se ligarem a proteínas sinalizadoras ou efetoras, o que altera sua conformação e seu comportamento.
As proteínas de sinalização intracelular agem na via de sinalização por uma ou mais formas listadas a seguir:
• Transmitir a mensagem para a proteína seguinte na via.
• Atuar como suporte para outras proteínas (proteínas scaffold), o que impede a comunicação cruzada, pois há vias em que alguns dos componentes são os mesmos (como o módulo MAPK), e também faz com que as proteínas reunidas possam interagir de forma mais rápida e eficiente. Por meio dessas proteínas de suporte formam-se os complexos de sinalização, que podem ser organizados antes de se receber o sinal ou apenas em resposta ao sinal. Em muitos casos, o próprio receptor pode ser o sítio de ancoragem das proteínas quando alguns de seus aminoácidos estão fosforilados, lipídeos especiais (fosfoinosídeos) também atuam dessa forma. A aproximação é útil também para a ativação das proteínas em alguns casos (proximidade induzida).
Figura 5 – Proteína scafold servindo de suporte para outros sinalizadores.(Animação: Rafael Seigi Kohasigawa)
• Transduzir (transformar) o sinal recebido, que se torna mais adequado para ser passado adiante.
• Amplificar o sinal por meio da produção de amplas quantidades de segundos mensageiros ou acionando múltiplas cópias de uma proteína sinalizadora.
• Integrar sinais, recebendo-o a partir de mais de uma via e sendo ativadas apenas quando recebem múltiplos sinais convergentes.
• Propagar o sinal de uma via para outra, criando ramificações na sinalização.
• Ancorar uma ou mais proteínas para conduzir o sinal para uma determinada estrutura da célula.
• Modular a atividade de outras proteínas sinalizadoras, regulando a intensidade do sinal. Grande parte das vias de sinalização possui mecanismos de retroalimentação, que pode ser de dois tipos:
– Positiva, quando o produto estimula sua própria produção. Respostas de retroalimentação positiva tem efeitos diferentes de acordo com sua intensidade: se for fraca, produzirá um aumento abrupto da resposta, se for forte, produzirá uma resposta muito alta e autossustentada, de forma que a resposta não diminui mesmo que a intensidade do sinal tenha caído. Essas respostas fortes são importantes para a célula tomar decisões do tipo “tudo ou nada” estáveis, cujas mudanças são de longa duração e passam para suas células-filhas, o que é essencial durante o desenvolvimento, quando a variação da concentração de morfógeno deve induzir a diferenciação das células.
– Negativa, quando o produto inibe sua produção, abreviando e limitando o grau da resposta. Também há variação qualitativa nesses tipo de resposta de acordo com a força do sinal: se o for retardo curto, há um fenômeno conhecido como adaptação – a resposta inicial é forte, mas decai mesmo com a persistência do sinal, e se há aumento da intensidade do sinal, a resposta aumenta novamente –que é muito útil para detectar mudanças na concentração de ligante, ao invés de reagir à concentração absoluta; e se o retardo for longo pode produzir respostas oscilantes.
Outra característica das vias de sinalização é a capacidade de ajustar sua sensibilidade, respondendo a variações do estímulo em uma ampla escala de intensidades de um sinal. Isso é conhecido como adaptação, que funciona basicamente por causa da retroalimentação negativa de retardo curto. A adaptação pode ocorrer de diversos modos:
– Endocitose e sequestro do receptor, que pode ser temporário ou pode levar a sua quebra nos lisossomos (retrorregulação do receptor). É importante notar que a endocitose apenas não significa sempre que o receptor esteja inativo, ele pode continuar ativo mesmo dentro de uma vesícula sinalizadora.
– Inativação dos receptores na superfície celular.
– Inativação das proteínas sinalizadoras.
– Produção de proteínas inibidoras.
GPCRs e componentes da via de sinalização
Os GPCRs são a maior família de receptores de superfície e são responsáveis pela mediação da maioria das respostas aos sinais extracelulares, tanto que metade dos fármacos conhecidos atua por meio desses receptores. As moléculas-sinal variam em sua função e estrutura e uma mesma molécula pode ativar GPCRs diferentes, que produzem respostas diferentes ao ligante.
Os receptores dessa família tem uma estrutura semelhante: uma única cadeia proteica que atravessa a bicamada lipídica sete vezes (por isso também é chamado algumas vezes de receptor de sete hélices). Eles interagem com o ligante por meio de um domínio extracelular grande juntamente com alguns dos segmentos transmembrana.
Quando uma molécula-sinal se liga ao GPCR, ele sofre uma mudança conformacional, ativando uma proteína G (proteína trimérica de ligação a GTP). A proteína possui três domínios, sendo que em α está o sítio para ligação de GDP, o qual é trocado por GTP pela ação do GPCR (atua como GEF – fatores de troca de nucleotídeos de guanina, ativando a proteína G, no caso). A troca produz uma mudança conformacional que separa a subunidade α do complexo βγ. Essa separação expõe sítios em α e em βγ que atuam sobre as proteínas alvo. O GTP é então clivado rapidamente e a proteínas G volta a sua forma inativa, pois α possui atividade GTPásica e por essa atividade ser aumentada por GAPs (proteínas de ativação de GTPase, que inativam a proteína G, no caso), no caso RGS (regulador de sinalização da proteína G). Abaixo, isso está esquematizado.
Há três formas gerais de adaptação para os GPCRs: Inativação, sequestro e retrorregulação, que dependem da fosforilação do receptor por PKA, PKC ou GRKs (cinases dos GPCRs). O sequestro e a retrorregulação do GPCR dependem da ligação dele com uma arrestina, o que se dá pela alta afinidade dela pelos sítios fosforilados do receptor. A arrestina contribui de duas formas para a dessenssibilização: impede a interação do GPCR com a proteína G e serve como proteína adaptadora para a maquinaria endocitica.
As principais vias ativadas por proteína G são:
- cAMP: A proteína G estimuladora (Gs) ativa a enzima adenilil-ciclase que produz cAMP (AMP cíclico) a partir de ATP, enquanto que a proteína G inibidora (Gi), inibe essa enzima. A degradação do cAMP se dá pela ação de fosfodiesterases de cAMP, que o hidrolisam a AMP.
O principal modo de o cAMP agir em células animais é a ativação da PKA (proteína-cinase dependente de cAMP), que é uma serinatreonina-cinase e que possui duas subunidades reguladoras e duas subunidades catalíticas. A ligação de cAMP às subunidades reguladoras causa a dissociação o complexo e a ativação das subunidades catalíticas, que fosforilam substratos específicos, os quais variam de acordo com o tipo celular e a molécula-sinal extracelular. Dessa forma, o cAMP pode mediar tanto processos de curta duração, como a modificação de proteínas, quanto de longa duração, como a transcrição de genes específicos.
Uma proteína que participa da regulação da transcrição de genes é CREB (proteína de ligação a CRE), que se liga à região reguladora de um gene, chamada de CRE (elemento de resposta ao cAMP). CREB fosforilado pela PKA recruta um coativador chamado CBP (proteína de ligação a CREB), o que estimula a transcrição do gene alvo. Essa via de sinalização controla muitos processos celulares, como a síntese de hormônios e a indução da memória de longa duração. A via está esquematizada abaixo.
Relevância Clínica
Algumas toxinas de bactérias agem sobre Gs ou Gi. A toxina da cólera mantém ativa uma Gs por impedir a hidrólise do GTP da subunidade α, o que estimula indefinidamente a adenilil-ciclase. O aumento do nível de cAMP no epitélio intestinal provoca a excreção excessiva de Cl– e de água para a luz intestinal, causando uma diarreia muito severa. Já a toxina pertussis, produzida pela bactéria da coqueluche, faz com que uma proteína Gi retenha seu GDP, impedindo-a de regular as proteínas-alvo. Ambas as toxinas são muito utilizadas em estudos com proteínas Gs ou Gi.
- Fosfolipideo de inositol: a fosfolipase C-β (PLC-β), enzima de membrana que atua sobre um fosfoinosídeo chamado PIP2 (fosfatidilinositol 4,5-bifosfato) e que é ativada principalmente por Gq. A clivagem de PIP2 gera dois produtos: IP3 (inositol 1,4,5-trifosfato) e diacilglicerol, ambos atuam como segundos mensageiros. O IP3 é hidrossolúvel e atua pela ligação a receptores de IP3, que são canais para Ca2+ do retículo endoplasmático, aumentando a [Ca2+]ic rapidamente.
O diacilglicerol é lipossolúvel e tem duas funções:
1) Papel potencial na sinalização, podendo ser clivado e liberar ácido aracdônico, que pode ser usado como segundo mensageiro ou para produzir eicosanoides, como as prostaglandinas. Elas tem importante participação nas respostas inflamatórias e à dor, tanto que muitos anti-inflamatórios (aspirina, cortisona) inibem sua síntese.
2) Ativação da PKC, uma serinatreonina-cinase, em conjunto com o Ca2+. A PKC, chamada assim pela sua dependência de Ca2+, fosforila diversas proteínas dependendo do tipo celular em que está presente.
A via está esquematizada abaixo.
Canais podem ser ativados diretamente por proteína G, como é o caso de canais de K+ de um miócito, que são abertos pelas subunidades βγ de uma Gi. Isso acontece pela ligação de acetilcolina a receptores muscarínicos no miócito, e o resultado é a diminuição da velocidade e força de contração do músculo cardíaco, o que ocorre por causa da hiperpolarização provocada pela abertura dos canais de K+.
Receptores de superfície associados a enzimas
Existem seis classes desse tipo de receptor: receptores tirosina-cinase, receptores associados à tirosina-cinase, receptores serinatreonina-cinase, receptores associados à histidina-cinase, receptores guanilil-ciclase, tirosina fosfatases. Dessas, serão tratadas as primeiras quatro classes.
Receptores tirosina-cinases e componentes de vias de sinalização
Esses são os receptores mais numerosos entre os que são associados a enzimas, e são exemplos da família o EGF (fator de crescimento epidérmico), o IGF-1 (fator de crescimento-1 semelhante à insulina) e o VEGF (fator de crescimento vascular). Os RTKs mais abundantes são os receptores Eph, que tem como ligante as proteínas-sinal transmembrana chamadas efrinas. A sinalização por meio do Eph é bidirecional, pois as efrinas e os Eph atuam tanto como ligantes quanto como receptores, transmitindo um sinal em ambas as células. Esse tipo de sinalização é importante no desenvolvimento, impedindo que grupos de células se misturem, entre outros casos.
Quando uma molécula-sinal se liga ao RTK, ela induz a dimerização do receptor, aproximando os domínios cinase de cada α-hélice e ativa, por proximidade induzida, sua atividade cinásica, o que faz os dímeros se fosforilarem mutuamente em múltiplas tirosinas (transautofosforilação). A fosforilação contribui de duas formas para a ativação: aumenta a atividade cinásica do RTK e cria sítios de ancoragem para proteínas da via de sinalização, sendo que cada uma se liga a um sítio diferente por reconhecer a cadeia polipeptídica ao invés de apenas a fosfotirosina.
Algumas proteínas são apenas adaptadoras de acoplamento entre o RTK e uma outra proteína, aumentando também o número de sítios de ancoragem, pois contém muitos domínios SH2 e SH3 (regiões de homologia 2 e 3 com Src) que servem para interação entre proteína e a fosfotirosina.
Algumas proteínas muito importantes na via de sinalização por RTKs são:
– Proteínas da superfamília Ras: consiste em muitas famílias de GTPases monoméricas, mas apenas as da Ras e da Rho estão envolvidas com sinalização, cujos membros são importantes centros de sinalização, pois podem propagar coordenadamente o sinal para diversas vias. A ativação da proteína pode se dar tanto pela ativação de uma Ras-GEF ou pela inibição de uma Ras-GAP, normalmente ela se dá pelo acoplamento indireto com Ras-GEF.
– Ras: um dos mecanismos pelo qual Ras afeta a transcrição gênica é o módulo MAP-cinase (módulo proteína-cinase ativada por mitógenos), que é formado por três cinases conhecidas nos mamíferos como Raf (MAPKKK), Mek (MAPKK) e Erk (MAPK). A Erk MAP-cinase entra no núcleo e fosforila componentes reguladores da transcrição de genes precoces imediatos chamados assim por serem ativados poucos minutos após a ligação da molécula-sinal extracelular, que serão responsáveis pela ativação de outros genes. Um gene que é ativado dessa forma é o que codifica as ciclinas GI, necessárias à proliferação celular. A via está esquematizada no vídeo abaixo.
O efeito de um módulo MAP-cinase pode variar profundamente de acordo com a duração de sua ativação. Em uma linhagem precursora neural, a ativação por EGF tem curta duração e faz as células entrarem em divisão, já a sinalização pela ligação da molécula-sinal ao receptor NGF, nas mesmas células, ativa Erk por várias horas e causa parada da divisão e diferenciação celular.
Como alguns módulos usam as mesmas MAP-cinases, para que cada um possa gerar uma resposta diferente proteínas de suporte são usadas, embora isso reduza as possibilidades as possibilidades de amplificação e disseminação do sinal para outras partes da célula.
– Rho: os membros dessa família são responsáveis por regular o citoesqueleto de actina e os microtúbulos, regulando a forma, polaridade, motilidade, adesão da célula, migração celular e crescimento de axônios; e também regulam a progressão do ciclo celular, o transporte por membrana e a transcrição gênica. Uma importante proteína de orientação extracelular que age por meio da proteína Rho é a efrina, responsável pelo direcionamento do crescimento de axônios entre outras funções.
– PI 3-cinase: enzima que fosforila fosfoinosídeos, possui função central na promoção de sobrevivência celular e no crescimento. O mais importante fosfoinosídeo que ela fosforila é o PIP3, que serve como sítio de ancoragem para várias proteínas sinalizadoras, podendo formar complexos de sinalização. O prolongamento da sinalização, entretanto, pode causar câncer, como no caso em que fosfatase PTEN, que inibe a via, está mutada e é incapaz de controlar a sinalização pela PI 3-cinase, causando crescimento descontrolado.
Uma proteína importante ativada por meio da PI 3-cinase é a Akt (também chamada PKB), que estimula o crescimento da célula e inibe a apoptose, sendo a principal via estimulada pela insulina e pelo IGF1.
Já o crescimento celular utiliza mTOR, que existe em dois complexos distintos: mTORC1, que estimula o crescimento celular pois incita a produção de ribossomos, a síntese proteica, a inibição da degradação de proteínas, o metabolismo e a captação de nutrientes; e o mTORC2, que atua na ativação de Akt e na regulação do citoesqueleto de actina. As vias estão esquematizadas abaixo.
Receptores associados a tirosina-cinases
Esses receptores agem por meio de tirosina-cinases citoplasmáticas, pertencendo a essa categoria os receptores de antígenos e interleucinas de linfócitos, receptores de citocininas e hormônios, e também integrinas, principal família de receptores para a célula se ligar à matriz extracelular.
As integrinas, quando ativadas, desencadeiam a formação de adesões focais, formadas por proteínas como FAKs (cinase de adesão focal) e Src, que fosforilam uma a outra e a outras proteínas que se agrupam na junção. A via sinaliza então para a célula que ela está aderida a um substrato adequado a sua sobrevivência e multiplicação.
Os receptores de citocininas compõe a maior classe da categoria dos receptores associados a tirosina-cinases, englobando receptores para mediadores locais (citocininas) e hormônios, como o GH e a prolactina. O funcionamento da via está esquematizada abaixo.
A modulação da via é feita por proteínas inibitórias cuja transcrição é ativada pelas JAKs, atuando sobre as próprias JAKs ou sobre as STATs, mas ambas só são inativadas pela ação de tirosina-fosfatases específicas. A ação dessas enzimas garante que as fosforilações tenham curta duração.
Receptores serinatreonina-cinases
Os principais ligantes desses receptores são TGFβ (superfamília fator de crescimento e de transformação β), que atuam como hormônios ou mediadores locais. Esses ligantes sinalizam para regulação do padrão de formação e comportamentos celulares, como proliferação e diferenciação, sendo classificadores morfogênicos.
Existem duas classes de receptores serinatreonina-cinases, tipo I e tipo II, sendo que o receptor tipo II fosforila o tipo I após terem recebido o sinal.

Figura 6 –
A endocitose dos receptores pode levar a dois efeitos distintos:
• Mais ativação, em que atua uma proteína chamada SARA (âncora de Smad para ativação do receptor) se liga ao receptores TGFβ e às Smads, aumentando a eficiência da atividade cinásica do receptor.
• Inativação, que conduz a ubiquitinação e degradação do receptor nos proteossomos.
Entre os genes-alvo ativados pelas Smads estão Smads inibitórias, como Smad6 e Smad7, que fazem isso dos seguintes modos:
• Compete com R-Smad, reduzindo a fosforilação dessa proteína.
• Recruta uma ubiquitina-ligase chamada Smurf (fatores reguladores de ubiquitinação de Smads) que ubiquitina o receptor e as Smads, levando a sua degradação.
• Recruta uma fosfatase que inativa o receptor.
• Ligam-se à Smad4, inibindo-a.
Vias dependentes de proteólise
Essas vias são muitos importantes para o desenvolvimento e a imunidade, e atuam por mecanismos diferentes dos já descritos: várias delas utilizam proteólise regulada para controlar proteínas reguladoras gênicas latentes. Por ativar essas proteínas, a via é mais direta para o controle da expressão gênica, atuando principalmente sobre decisões dos destinos celulares.
Quatro dessas vias serão discutidas nessa seção: a do receptor Notch, ativadas por proteínas Wnt, por proteínas Hedgehog e a da proteína reguladora gênica NFκB, todas muito importantes para o desenvolvimento.
Sinalização Notch ou Delta
A via atua no direcionamento do destino das células e na regulação do padrão de formação de tecidos durante seu desenvolvimento e renovação, tanto que não há comportamento celular no desenvolvimento que deixe de ser regulado pela via Notch. A via atua tanto inibindo como induzindo, em situações diferentes, a formação de tipos celulares distintos dentro de um mesmo tecido.
O receptor Nocth necessita de processamento proteolítico para que possa funcionar, de modo que a ativação dele é irreversível e a proteína não pode ser utilizada outra vez. Uma vez ativado, a parte intracelular atua como uma proteína reguladora gênica latente, sendo que os genes ativados variam de acordo com o tecido e as circunstâncias, mas em geral pertencem a uma família conhecida como Hes, que codificam proteínas reguladoras gênicas inibidoras. O vídeo abaixo esquematiza a via.
Tanto Notch quanto Delta são glicoproteínas e a interação entre eles varia de acordo com a glicosilação do receptor.
Vias dependente de Wnt
Os ligantes Wnt atuam como mediadores locais e morfógenos no controle de múltiplos aspectos do desenvolvimento, iniciando sempre pela ativação de receptores Frizzled, o que recruta a proteína de suporte Dishevelled. As proteínas Wnt podem ativar pelos menos uma das seguintes vias:
• Via Wnt/β-catenina (via canônica).
• Via de polaridade planar, que controla a polaridade das células em epitélios.
• Via Wnt/Ca2+, que estimula o aumento de Ca2+.
Será descrita apenas a primeira via, que atua pela regulação da proteólise de uma β-catenina, proteína que atua na adesão celular e na regulação gênica. A via está esquematizada abaixo.
Relevância Clínica
O gene Apc está mutado em 80% dos cânceres de cólon, essa relação existe por causa da sua função inibidora na via Wnt, e com a perda dela genes estimuladores do crescimento e da proliferação ativados pela β-catenina, como c-Myc, ficam ativos mesmo na ausência do sinal.
Vias ativadas por Hedgehog
A sinalização por Hedgehog promove sinalização celular, tanto que caso seja excessiva pode causar câncer. Isso ocorre em carcinomas basocelulares de pele, em que há mutações de genes Patched que inibem a sinalização por Hedgehog.
Proteínas Hedgehog são codificadas por pelo menos três genes em vertebrados (Sonic, Desert, Indian) e três proteínas medeiam sua resposta: Patched, Smoothened e iHog.
Figura 7 –

Em vertebrados, os cílios primários atuam como centros de sinalização de Hedgehog, pois concentram proteínas sinalizadoras da via. Acredita-se que essa organização aumente a velocidade de sinalização e a sua eficiência.
Vias dependentes de NFκB
NFκB são proteínas reguladoras gênicas latentes que estão envolvidas em respostas do sistema imune (inflamatórias, estressantes e inatas) e no desenvolvimento animal. Vários receptores ativam essa via de sinalização, como os TLR (receptores tipo Toll), receptor IL-1 (receptor tipo interleucina 1) e receptor TNF. Todos esses receptores atuam de forma semelhante: ao serem ativados, desencadeiam ubiquitinação e fosforilação em várias proteínas, o que libera NFκB de um complexo inibidor, possibilitando que a proteína vá para o núcleo, onde ativa genes. Isso está esquematizado no vídeo abaixo.
A retroalimentação negativa da via é dada por uma proteína transcrita por um gene ativado pela NFκB, o qual codifica IκBα, proteína que mantém a NFκB inativa.
