Arthur Tributino Menezes
Introdução
Os organismos vivos são compostos de unidades funcionais conhecidas como células. No interior de cada uma destas unidades ocorrem inúmeras reações e processos metabólicos, os quais são regulados e levados a cabo por mais um sem número de macromoléculas biológicas, em sua maioria proteínas. As células não param, têm de se manter em funcionamento contínuo e ainda produzir o que necessitam para continuar funcionando de maneira adequada.
Tais máquinas incríveis encerram em si um universo que nos parece tão caótico e impossível para algo tão pequeno como o é uma célula, mas todos os processos são finamente regulados e orquestrados pela própria célula com maestria. Mesmo essa incrível máquina que parece ser capaz de qualquer coisa não pode escapar do inevitável: a morte. As células do nosso corpo são constantemente renovadas, sendo substituídas quando chegam ao fim de suas vidas, ou ainda quando são danificadas ou abrigam algum tipo de patógeno. Organismos são máquinas vivas que não podem parar nem um segundo, as suas células estão ativas o tempo todo desempenhando os seus determinados papéis nos tecidos aos quais elas pertencem, incansavelmente. Para que essa máquina viva seja mantida em funcionamento as suas células que já não apresentam um bom funcionamento devem ser substituídas. Mas mesmo quando uma célula que trabalhou a sua vida inteira sai de cena, esse processo deve ser finamente regulado de modo a não causar danos ao organismo: a esse processo damos o nome de morte celular programada. No entanto, nem sempre a morte de uma célula é algo previsto e programado, e outros processos entram em vigor quando esta morte ocorre de forma repentina e violenta.
Todas as nossas células estão programadas para morrer! Parece desesperador? Na verdade, nem tanto. É fácil aceitar a ideia de que uma célula defeituosa ou já velha do nosso corpo entrou em processo de morte celular, claro, ela já não é mais a mesma e não nos serviria mais para muita coisa. Mas e se pensarmos que células do nosso corpo, perfeitamente saudáveis e em bom funcionamento, são condenadas à morte ainda muito, muito jovens?! Parece terrível, não é verdade?! Sendo bom ou ruim, a verdade é que isso acontece o tempo todo. A morte celular também é um mecanismo pelo qual um organismo pode moldar seus tecidos ao longo do seu desenvolvimento. Por exemplo, em embriões de camundongos, nos primeiros dias do desenvolvimento há uma membrana entre os dedos unindo-os uns aos outros, a qual é conhecida como membrana interdigital. As células que compõem essa membrana sofrem morte celular ao longo do desenvolvimento do embrião, de modo que os dedos do camundongo vão sendo moldados e podem ser movidos de forma independente entre si. O mesmo ocorre com a cauda de girinos no desenvolvimento de sapos. Por morte celular, essa cauda vai sendo retraída em jovens que estão em metamorfose para a fase adulta. No homem a morte celular também pode funcionar assim. Durante a determinação do sexo, por exemplo, as células dos ductos müllerianos sofrem morte celular nos indivíduos do sexo masculino. Outro caso muito comum é a morte de inúmeras células T imaturas no interior do timo, na construção das defesas imunológicas do nosso corpo. E para não ficarmos somente no mundo animal, devemos lembrar que nas plantas a morte celular também ocorre. Seguindo a linha de raciocínio dos exemplos dados até agora, podemos pensar no desenvolvimento da complexa estrutura reprodutiva presente em muitas plantas: as flores. Estas estruturas belíssimas que nos chamam tanto a atenção, tanto pela sua aparência como pelo seu aroma, são, como bem sabemos, efêmeras. Após cumprirem a sua função, as pétalas das flores murcham e caem, e outras estruturas das flores também morrem, enquanto outras são preservadas e modificadas. Em toda essa dinâmica de transformação sofrida por uma flor, a morte celular programada está presente desempenhando o seu papel.
Um ponto de extrema importância a ser levantado é a relação de defeitos no sistema de morte celular com doenças graves como o câncer, a doença de Alzheimer e a AIDS. Nessas doenças a morte celular está fora de controle, ou porque as células tornam-se imortais e proliferam desenfreadamente (como é o caso do câncer), ou porque elas morrem quando não deveriam, sendo bem difícil a sua reposição, como é o caso de doenças neurodegenerativas como o Alzheimer.
Enfim, até aqui já podemos talvez enxergar a morte celular como algo totalmente diferente: o que deveria ser simplesmente o fim de toda uma unidade funcional que já não é mais necessária passa a ser um novo evento que também deve ser bem regulado e preciso.
Sinais que podem induzir a morte celular
Como um evento regulado e preciso, a morte celular necessita de um estímulo inicial para acontecer. Este estímulo pode ter origem no interior da própria célula, por exemplo, quando esta sofre quebra em alguma das fitas do DNA, o que normalmente é provocado por radiação ionizante ou agentes quimioterápicos. Esse método é utilizado, inclusive, no tratamento de alguns tipos de câncer. A indução da morte de células cancerígenas por radiação pode ajudar no controle do crescimento e proliferação de um tumor em desenvolvimento.
O estímulo para a morte celular pode ser também externo, como é o caso de células portadoras de patógenos (vírus e bactérias, por exemplo). A célula infectada irá expressar receptores de superfície sinalizando que porta um patógeno. Tal receptor será reconhecido por um linfócito T citotóxico (célula do sistema imune), o qual irá induzir a morte dessa célula infectada e consequentemente a destruição do patógeno que ela carrega. Outro tipo de estímulo externo pode ser por meio de fatores de sobrevivência, os quais são enviados por outras células. Se a célula receptora não recebe esses sinais ela entra em processo de morte celular. Alguns desses fatores podem ser linfocinas (sobrevivência de timócitos), fatores de crescimento de nervos (sobrevivência de neurônios) e outros provenientes da matriz extracelular (sobrevivência de células epiteliais). Enfim, os estímulos que podem desencadear a morte de uma célula são inúmeros. É importante saber que esses estímulos podem ser recebidos e interpretados de diferentes formas por diferentes tipos celulares. Por exemplo, um mesmo estímulo que promoveria a sobrevivência de um determinado tipo celular pode induzir a morte de outro tipo de célula, bem como estímulos opostos podem causar um mesmo efeito. Para ilustrar, o aumento de níveis hormonais (glicocorticóides) provoca a morte de timócitos, mas a queda de níveis hormonais também pode fazê-lo (morte de células da próstata ventral após castração, por exemplo).
Necrose X Apoptose
Comumente distinguem-se dois tipos de morte celular: um deles é conhecido como necrose ou morte celular acidental, e o outro como apoptose, que é um tipo de morte celular programada.
Na necrose, as células iniciam o seu processo de morte devido ao sofrimento de algum trauma ou injúria, em geral de origem física ou química, como falta de oxigênio, extremos de temperatura, entre outros. Neste processo, a célula passa a absorver e acumular uma grande quantidade de água, o que leva ao aumento do seu volume interno e consequentemente ao rompimento e dissolução de suas organelas, bem como a sua digestão por enzimas celulares (Figura 1).
Figura 1 – Processo de necrose celular. Após receber algum trauma ou injúria, as células e as suas organelas passam a devido à absorção de água. Então, as organelas e as células se rompem e o seu conteúdo é extravasado, o que gera um sinal pró inflamatório recrutando células fagocíticas. Baseado em Pollard, et al. 2006. (Créditos: Arthur Tributino Menezes)
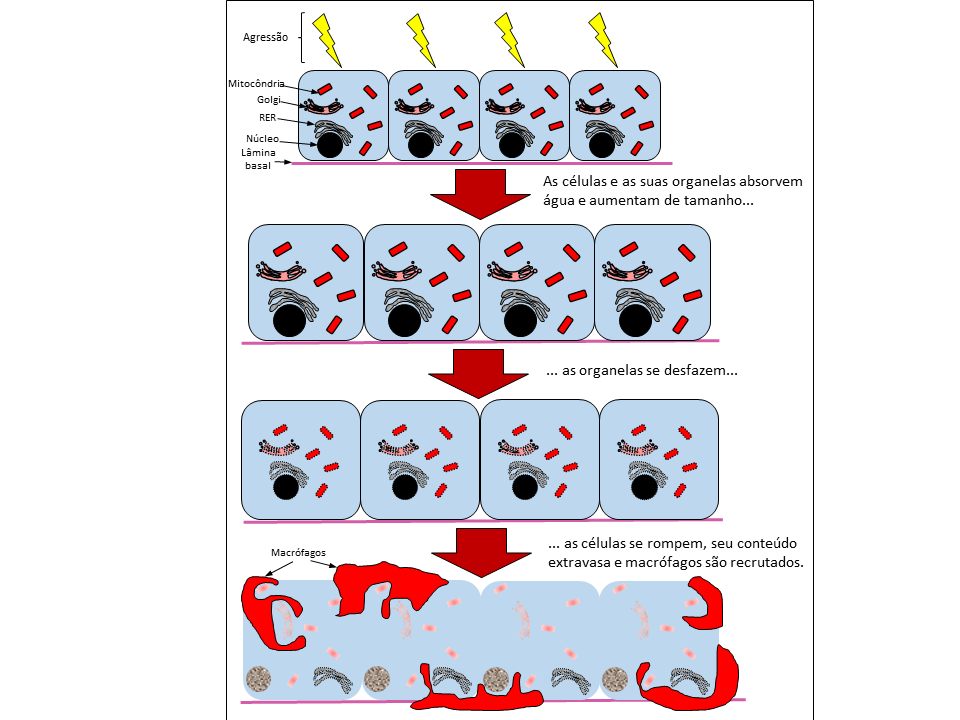
Logo a membrana plasmática da própria célula também é destruída e todo esse conteúdo é extravasado, o que gera um sinal que desencadeia uma inflamação local recrutando células do sistema imune, como macrófagos que irão fagocitar os restos das células em processo de necrose. Vale ressaltar aqui que este processo é desencadeado em células que estão danificadas, o que não necessariamente será o caso das células que entram em apoptose. Além disso, o processo de necrose geralmente envolve um grande número de células vizinhas entre si, e o conteúdo celular extravasado acaba afetando negativamente essas células vizinhas.
Na apoptose as células podem estar aparentemente muito bem, e de fato não apresentarem nenhum tipo de dano. Este processo inicia-se com uma diminuição do tamanho da célula, em contraste com o que vimos anteriormente sobre a necrose (figura 2).
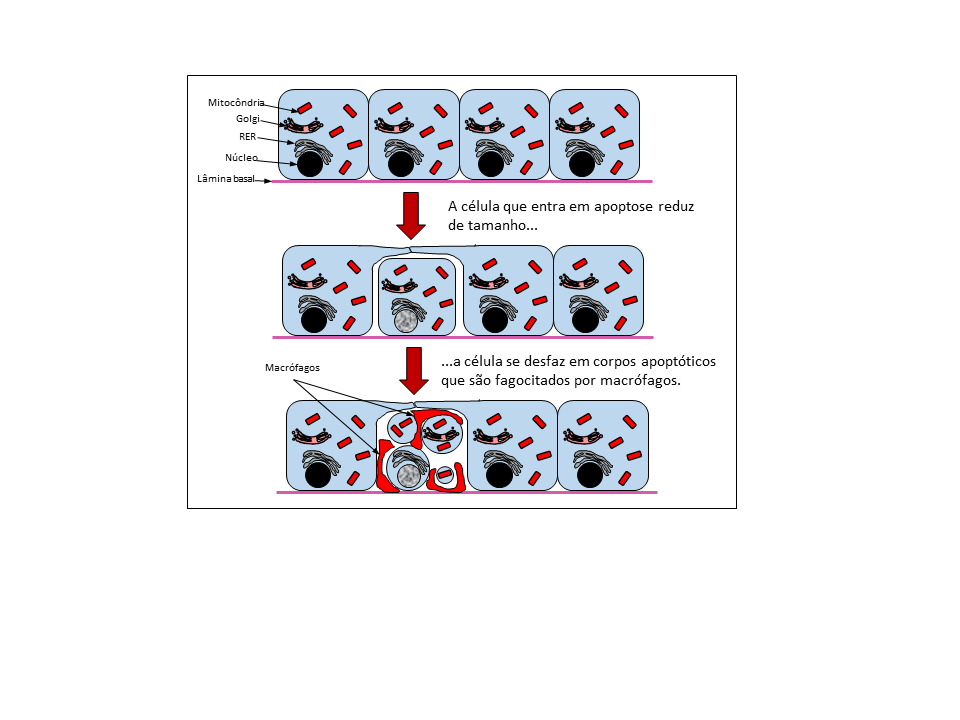
Figura 2 – Processo de apoptose. Notar que aqui o conteúdo celular não é extravasado, a membrana celular é mantida íntegra durante todo o processo. Os corpos apoptóticos são fagocitados e o seu conteúdo é digerido. Baseado em Pollard, et al. 2006. (Créditos: Arthur Tributino Menezes)
Aqui há um padrão geral no mecanismo de morte celular, que tipicamente envolve apenas uma única célula, sem afetar as células vizinhas. No início do processo a célula perde as suas microvilosidades e proteínas de adesão. Em seguida há um encolhimento do citoplasma e uma grande redução na motilidade deste (movimento das organelas através do citoplasma é reduzido). A membrana então perde a sua assimetria, de modo que a fosfatidilserina, um fosfolipídeo que normalmente está localizado na face interna da membrana plasmática, passa a localizar-se também na face externa da membrana. Também ocorrem alterações no núcleo, normalmente a hipercondensação da cromatina e seu colapso contra a parede nuclear. Finalmente, a célula se desmembra em corpos apoptóticos, que são vesículas contendo os restos de citoplasma e organelas da célula que entrou em apoptose. Notem que ao longo de todo o processo a membrana celular não foi rompida, mas envolve as vesículas formadas ao final do processo, os chamados corpos apoptóticos. Desse modo, o conteúdo da célula não é extravasado e não desencadeia uma resposta inflamatória como ocorre no processo de necrose. Esses corpos apoptóticos então são englobados por células fagocíticas em circulação pelo tecido (comumente macrófagos migratórios). Os corpos apoptóticos apresentam ainda marcadores de superfície, a fosfatidilserina que esta exposta do lado externo da membrana, que inibem a ativação dos macrófagos que os fagocitam, evitando assim o desencadeamento de uma resposta inflamatória.
Podemos ainda dividir o processo de apoptose em duas fases: a fase latente e a fase de execução. Uma célula que inicia o processo de apoptose, seja por um sinal interno (como danos no DNA) ou externo (como a escassez de algum nutriente), não apresentará inicialmente sinais aparentes de ter ingressado no processo de morte celular. Nessa fase inicial, que é a fase latente, alguns processos são colocados em andamento na célula (ex.: expressão de genes específicos). No entanto, até um determinado ponto nesta fase a célula ainda pode voltar atrás interrompendo o processo (figura 3). A duração da fase latente pode variar de horas até dias, até mesmo para um mesmo grupo de células muito semelhantes entre si. Não se sabe ainda ao certo o que determina essa duração, mas existe um balanço entre as informações pró e anti-apoptóticas que a célula recebe num determinado momento.
Figura 3 – Diagrama esquemático ilustrando as diferentes fases do processo de apoptose. Baseado em Pollard, et al. 2006. (Créditos: Arthur Tributino Menezes)
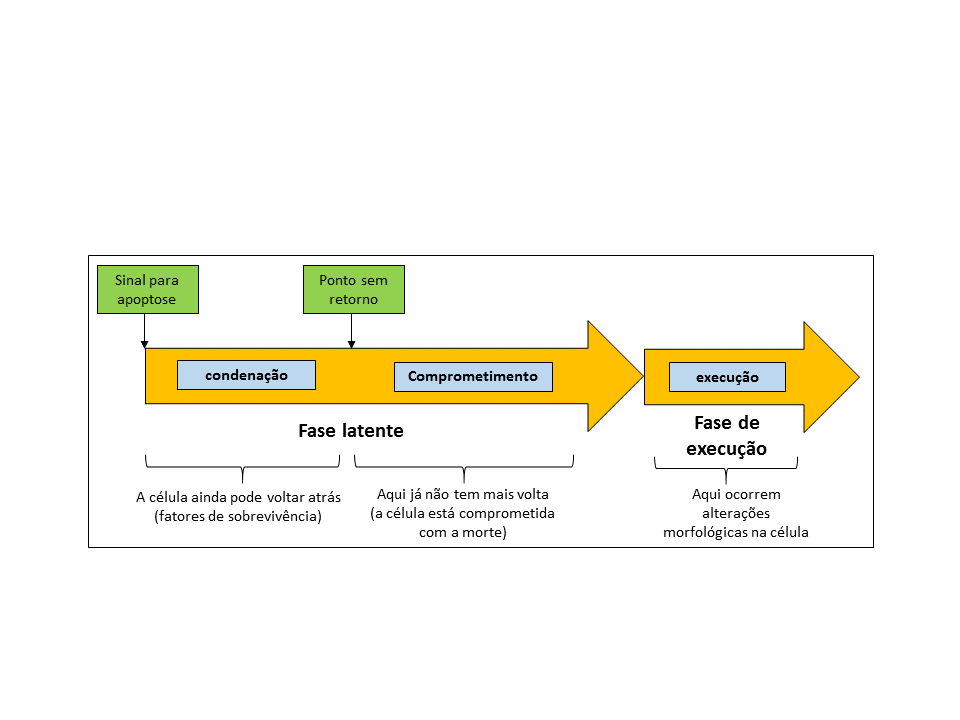
Após a fase latente a célula entra na fase de execução da apoptose, na qual ocorrem os eventos descritos anteriormente. Nesta fase a duração do processo é em geral de uma hora, e as diferentes etapas citadas acima são comumente observadas nos mais variados tipos celulares, de modo que podemos dizer que a fase de execução da apoptose é mais conservada do que a fase latente, a qual é bem mais variável.
Apoptose não é sinônimo de morte celular programada
Precisamos tomar cuidado com uma confusão muito comum quando estamos estudando morte celular. Muitas pessoas se confundem e acreditam que morte celular programada é sinônimo de apoptose, porém isso não é verdade. A apoptose é de fato um tipo de morte celular programada, porém existem outros tipos de morte celular programada. Estes outros tipos de morte celular programada não irão apresentar algumas das etapas da apoptose que estamos discutindo aqui, ou ainda podem apresentar passos diferentes. Dessa forma, temos que estar atentos com o que temos em mente quando falamos de apoptose e quando falamos de morte celular programada. Portanto, apesar dessa divisão clássica entre necrose e apoptose, recentemente os pesquisadores têm reportado outros tipos de morte celular programada que incluem entre outros a necrose regulada, autofagia, necroptose. Para quem quiser saber um pouco mais sobre esses processos, há artigos citados nas referências no final deste texto os quais podem ser consultados.
Proteína p53 e a apoptose
Sabe-se que a síntese de proteínas é um evento relativamente comum na fase latente do processo de apoptose, porém não é um evento observado em todos os casos, e nem se sabe ao certo todas as proteínas específicas sendo expressas pelas células durante este processo. No entanto, já se observou que alguns genes que são ativados pela proteína p53 estão envolvidos com a apoptose. A p53 é uma proteína supressora de tumor, e participa da regulação do ciclo celular quando ocorrem danos no DNA. De um modo geral, a p53 retarda o ciclo celular, de modo que as células ficam estacionadas entre as fases G1 e S. A sua superexpressão em linhagens celulares tumorais levou essas células a entrarem em apoptose, o que nos indica uma grande importância da p53 na defesa do organismo contra o câncer. Experimentos feitos com camundongos knockout para a proteína p53 corroboraram estas observações. Estes camundongos desenvolveram muitos tumores na fase adulta, o que seria atribuído à ausência da expressão de p53. Acredita-se que a p53 funcione como um ativador transcricional na promoção da apoptose, mas ela ainda pode atuar em uma outra via apoptótica que envolve as mitocôndrias.
Alguns genes e proteínas envolvidos com a apoptose
Muitos estudos têm sido feitos para entender melhor como funciona o processo de apoptose mais detalhadamente, e quais elementos celulares seriam mais importantes no desencadeamento desse processo. Em estudos feitos em C. elegans, alguns genes foram identificados como relacionados à apoptose. Tais genes podem ser organizados em 3 grupos de acordo com a sua função geral: I- genes relacionados à marcação da célula para posterior entrada em processo de morte celular; II- genes envolvidos no processo de morte celular em si, e em sua regulação; e III- genes envolvidos na fagocitose dos restos celulares e em processos subsequentes. Poderíamos nos perguntar porque estamos falando de genes envolvidos em apoptose em células de um animal tão diferente dos seres humanos como o pequeno verme C. elegans. Este pequeno animalzinho é considerado um organismo modelo para estudos genéticos. Em estudos desse tipo, busca-se compreender o funcionamento de genes homólogos aos de seres humanos, ou seja, genes que foram conservados evolutivamente, nesse caso, desde os pequeninos vermes até nós. Assim, entender o funcionamento de genes relacionados à apoptose nesses animais nos dá pistas para entender o funcionamento de genes homólogos a esses nos seres humanos. A tabela 1 abaixo mostra algumas proteínas de C. elegans envolvidos com a apoptose e seus respectivos homólogos em mamíferos.
Tabela 1 Proteínas de C. elegans envolvidas na apoptose e seus respectivos homólogos em mamíferos.
| C. elegans | Mamíferos |
|---|---|
A título de curiosidade e também para evitar confusões, note-se que quando escrevemos o nome de um gene o fazemos em itálico, sendo que o nome de sua respectiva proteína, que em muitos casos é o mesmo nome do gene, é escrito em formato sem ser em itálico. Os genes ced-3; ced-4 e ced-9 (ced = cell death abnormal) de C. elegans são os mais famosos e codificam as primeiras 3 proteínas que aparecem na tabela acima. ced-3 e ced-4 são indispensáveis para a morte celular programada, e ced-9 atua como regulador de ced-3 e ced-4. Na tabela são mostrados seus homólogos em mamífero e faremos uma breve explicação de sua função na regulação da apoptose:
1) Caspases: pertencem a uma família de proteínas com função proteolítica e que são elas mesmas ativadas por proteólise (esse tipo de enzima é conhecida como zimôgenos). Dentro dessa família existem algumas caspases (na sua forma inativa são chamadas de pro-caspases) que são ativadas por vias pró-apoptóticas (induzem apoptose). Quando ativadas elas degradam componentes celulares durante o processo de apoptose, clivando proteínas estruturais específicas, no núcleo e no citoplasma. Também clivam proteínas quinases, além de outras proteínas envolvidas na detecção e reparo de danos no DNA. Há também a ação de nucleases durante o processo de morte celular, como a nuclease CAD (caspase activated DNase). Esta nuclease é expressa de forma complexada como seu inibidor, o ICAD. Assim, a nuclease é inativada no momento que é produzida, protegendo o DNA da célula de sua ação. Por ação de caspases, durante o processo de morte celular, o ICAD é clivado e a nuclease passa a ser ativa e começa a clivar o DNA da célula.
2) A Apaf-1 (apoptotic protease- activating factor-1) atua na formação de um complexo proteico que se liga a pro-caspases especificas induzindo sua ativação. Essa caspase agora pode ativar outras pro-caspases que ampliam o sinal pró-apoptótico e levam a degradação dos componentes celulares.
3) Proteínas da família da Bcl-2 representam uma família de proteínas que interagem entre si e contém membros que tem papel pró-apoptóticos (induzem a apoptose) como membros com papel anti-apoptóticos (inibem a apoptose). Essas proteínas estão envolvidas na ativação da apoptose pela via conhecida como intrínseca, a qual envolve liberação de proteínas mitocondriais, como citocromo c, por abertura de poros em sua membrana, como descrito abaixo.
Vias que levam a morte celular
Alguns receptores de superfície expressos pelas células são específicos para sinalizar a morte celular, e por isso são conhecidos como receptores de morte. Um desses receptores que é bastante conhecido é chamado de Fas. Esse receptor é expresso na superfície da célula, e fica ancorado na membrana, possuindo também um domínio intracelular, o domínio de morte. O ligante desse receptor é conhecido como ligante de Fas, e está presente, por exemplo, na superfície de células do sistema imune que monitoram o organismo em busca de células portadoras de patógenos, os linfócitos T citotóxicos. Células que expressem o Fas em sua superfície serão reconhecidas pelo ligante de Fas dos linfócitos. Esta ligação irá desencadear processos subsequentes que ativarão a via de morte celular, conhecida como via extrínseca. Nesses passos ocorre inclusive a ativação de caspases específicas que irão atuar ao longo de todo o processo. Há também a possibilidade de uma mesma célula que expressa o ligante de Fas passar a expressar o receptor Fas em sua superfície como forma de induzir a sua própria morte, como ocorre em linfócitos B e T após a sua ativação.
Outro ponto interessante é que há algumas células que expressam o ligante de Fas como forma de se protegerem de células efetoras do sistema imune que expressam o receptor Fas, como ocorre nos tecidos imunoprivilegiados. Exemplos desses tipos de tecidos são o cristalino e os testículos. Nesses tecidos é importante evitar a formação de respostas inflamatórias localizadas, assim, caso alguma célula do sistema imune entre nesses tecidos ela logo encontra um ligante de Fas e o processo de sua morte é ativado como vimos anteriormente. O problema é que algumas células tumorais “descobriram” essa estratégia e a utilizam para escapar da vigilância do nosso sistema imune. Essas células tumorais podem expressar um tipo de receptor de Fas que reconhece o ligante de Fas nas células citotóxicas e o bloqueia, evitando assim o desencadeamento do processo de morte. Outras células tumorais ainda podem expressar um receptor de Fas sem o domínio de morte intracelular, sendo essa mais uma estratégia eficiente de evasão da morte.
Outra via que leva a morte celular envolve as mitocôndrias, e por isso é conhecida como via mitocondrial de morte celular ou intrínseca. As mitocôndrias apresentam algumas proteínas em seu espaço intramembranar que quando liberadas no citoplasma têm papel ativo na regulação da via intrínseca da apoptose. Algumas proteínas pró-apoptoticas da família Bcl-2, como Bax e Bid, são capazes de formar poros na membrana mitocondrial permitindo a liberação dessas proteínas para o citoplasma. Bax e Bid são inibidas por sua interação com proteínas da família Bcl2 anti-apoptóticas, com por exemplo a própria Bcl2. Sinais pro-apoptóticos podem interferir no balanço entre proteínas pro- e anti- apoptóticas da família das Bcl2, fazendo com que Bax e Bid possam estar livres para formar os poros mitocondriais. Nesse caso há a liberação, entre outras proteínas, do citocromo c. este no citoplasma se liga à Apaf-1 e forma um complexo conhecido como apoptossomo. O apoptossomo então irá atuar na ativação de pro-caspases, que por sua vez amplificarão o sinal via a cascata de ativação descrita acima, levando a apoptose. Foi com surpresa quando os cientistas perceberam esse papel alternativo do citocromo c, uma proteína tão importante na cadeia de transporte de elétrons mitocondrial na respiração celular, na indução da apoptose. Afinal, não é de se esperar que uma proteína tão importante para a sustentação da vida tenha um papel contrastante induzindo a célula à morte.
Doenças e morte celular
Como mencionado anteriormente, algumas doenças estão diretamente envolvidas com a morte celular, mais precisamente quando esse processo não ocorre como e quando deveria. Exemplos bem conhecidos são o ataque do coração e o derrame. Em ambos os casos, grandes grupos de células podem sofrer necrose devido à falta de irrigação sanguínea adequada (isquemia), e ainda algumas células podem morrer também por apoptose em decorrência desse processo. Em outros casos, problemas com o processo de morte celular podem fazer com que células que deveriam morrer sobrevivam, e estas se acumulam no organismo causando problemas. Por exemplo, uma mutação que afete o receptor ou o ligante de Fas pode fazer com que linfócitos que reconhecem antígenos próprios sobrevivam. Estes linfócitos deveriam morrer por apoptose em uma situação normal, afinal não queremos células do nosso sistema imune atacando o nossos próprios tecidos. A sobrevivência destes linfócitos que reconhecem os nossos antígenos próprios pode levar ao desenvolvimento de uma doença autoimune. O câncer é outra doença que não poderia deixar de ser citada. Apesar do grande problema do câncer ser o fato de que as células que originam o tumor se dividem de forma descontrolada, problemas no processo de morte destas células também é um agravante. Há fármacos que atuam induzindo a morte das células tumorais, o que auxilia no tratamento do câncer, porém, alguns tipos de células possuem um bloqueio que impede o desencadeamento do processo de morte celular, de modo que estes fármacos são ineficazes nestes casos e o tumor continua a crescer desenfreadamente.
Links mortais:
• Vídeo do youtube mostrando o processo de apoptose de uma célula à partir de receptores de morte e formação do apoptossomo:
• Vídeo mostrando duas vias que levam a apoptose (via intrínseca e via extrínseca):
Referências
• Alberts, et al. 2011. Biologia Molecular da Célula. 5ª ed. Artmed;
• Pollard, T. D. et al. 2006. Biologia celular. 1ª ed. Elsevier.
Artigos necroptose e necrose regulada:
• Fulda S. The mechanism of necroptosis in normal and cancer cells. Cancer Biology & Therapy. 2013;14(11):999-1004. doi:10.4161/cbt.26428
• Kers, J. et al. (2016). An Overview of Pathways of Regulated Necrosis in Acute Kidney Injury. Seminars in Nephrology Volume 36, Issue 3, May 2016, Pages 139–152
• Meng, M., Wang, H., Cui, Y., Wu, Z., Shi, Y., Zaorsky, N., Deng, L., Yuan, Z., Lu, Y., & Wang, P. (2016). Necroptosis in tumorigenesis, activation of anti-tumor immunity, and cancer therapy.Oncotarget, 7(35), 57391-57413
