Arthur Tributino Menezes
Introdução
A arquitetura de um organismo pluricelular é algo fascinante, seja macro ou microscopicamente. Ali podemos encontrar inúmeros componentes que interagem entre si de maneira precisa e ordenada, de modo a viabilizar a existência de tal organismo.
O corpo humano, por exemplo, é organizado em diferentes sistemas que interagem entre si, de modo que a comunicação entre tais sistemas é essencial. Para termos uma ideia da importância dessa inter-relação entre diferentes componentes de um organismo, consideremos a seguinte analogia: quando ocorre o rompimento de uma barragem que represa um rio, por exemplo, é necessário o recrutamento e deslocamento de pessoas e recursos para fazer o reparo e conter o vazamento de água. No corpo humano, algo semelhante seria a migração de células para o local onde ocorreu um corte na pele. Células do sistema imune são recrutadas para a defesa, enquanto outras células trabalham para reparar o tecido danificado.
Na analogia feita acima, podemos notar a importância da propriedade de locomoção que algumas células precisam possuir para desempenhar as suas funções. A migração celular está envolvida com diversos processos, como o desenvolvimento embrionário, a defesa do organismo, a cicatrização, e a modelagem óssea. Além disso, a capacidade migratória de diferentes tipos celulares é importante no desenvolvimento e progressão de algumas patologias, tais como o câncer, de modo que tal tema é bastante estudado na tentativa de se desenvolverem novos fármacos.
Neste texto falaremos um pouco sobre a migração celular, quais os mecanismos envolvidos e quais processos estão relacionados a este comportamento das células.
Mecanismo de Locomoção – Migração de células isoladas
Nos animais em geral, a migração celular ocorre pelo deslizamento das células sobre algum substrato, exceção feita para os espermatozoides, que se movimentam pelo batimento de um flagelo. Tal movimento de deslizamento conta com o dinamismo dos elementos do citoesqueleto para ser levado a cabo.
A célula basicamente coordena a polimerização/despolimerização de filamentos proteicos de seu citoesqueleto de maneira ordenada, de modo a promover deformações em sua membrana que a impulsionam pelo substrato permitindo a sua migração.
Apesar da grande complexidade de processos envolvidos na migração de uma célula, podemos reconhecer três etapas gerais nas quais se divide o deslocamento celular sobre um substrato: etapa de protrusão, onde a célula “estica” uma porção de sua membrana plasmática no sentido em que pretende se movimentar; etapa de ligação, na qual a célula conecta a porção projetada de sua membrana a um ponto no substrato; e etapa de tração, na qual a célula “puxa” a si própria em direção ao ponto onde ela ancorou a sua projeção no substrato (Figura 1).
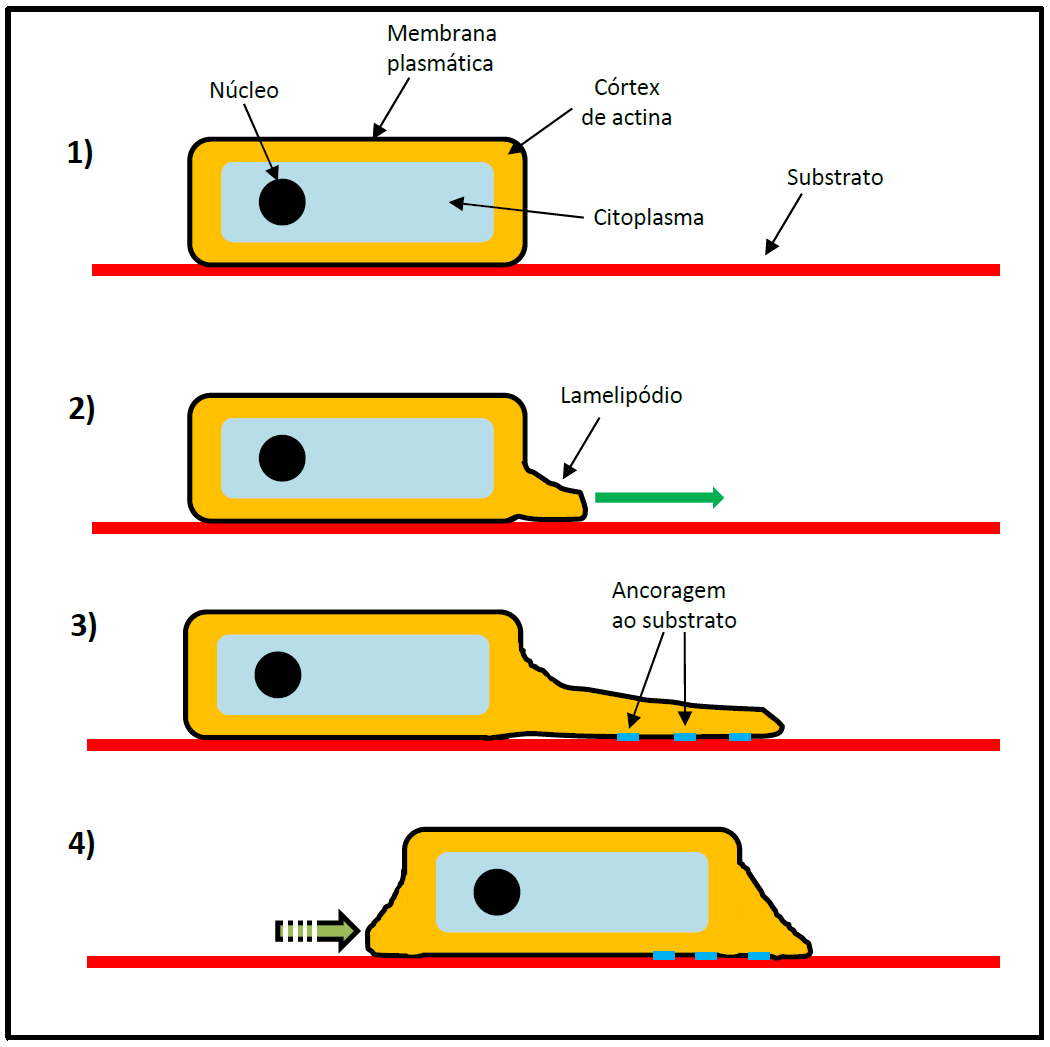
Figura 1 – Esquematização geral do deslocamento de uma célula sobre um substrato pela emissão de um lamelipódio. A rede de actina promove a projeção da membrana plasmática no sentido do movimento. A célula ancora essa projeção ao substrato por meio de estruturas de adesão, ao mesmo tempo em que a parte posterior da célula é contraída. Baseado em Alberts et al, 2011. (Créditos: Arthur Tributino Menezes)
A projeção da membrana plasmática no primeiro passo se dá através da polimerização de filamentos de actina no interior da célula. Os filamentos de actina são elementos que fazem parte do citoesqueleto, podendo ser remodelados de acordo com as necessidades da célula.
São distinguidos três tipos principais de protrusão da membrana celular usadas no deslocamento, de acordo com o seu formato: filopódios, que são mais finos e longos; lamelipódios, que são mais largos e achatados; e os pseudópodes, que são tridimensionais (Figura 2).
Figura 2 – Tipos de projeções da membrana plasmática que podem ser usados para locomoção. O citoplasma das células está na cor azul, e o núcleo na cor preta. As células “a” e “b” apresentariam essa configuração sobre uma superfície plana. Imagens fora de escala. (Créditos: Arthur Tributino Menezes; ilustrado por: Bruna Afetian Sollitto)
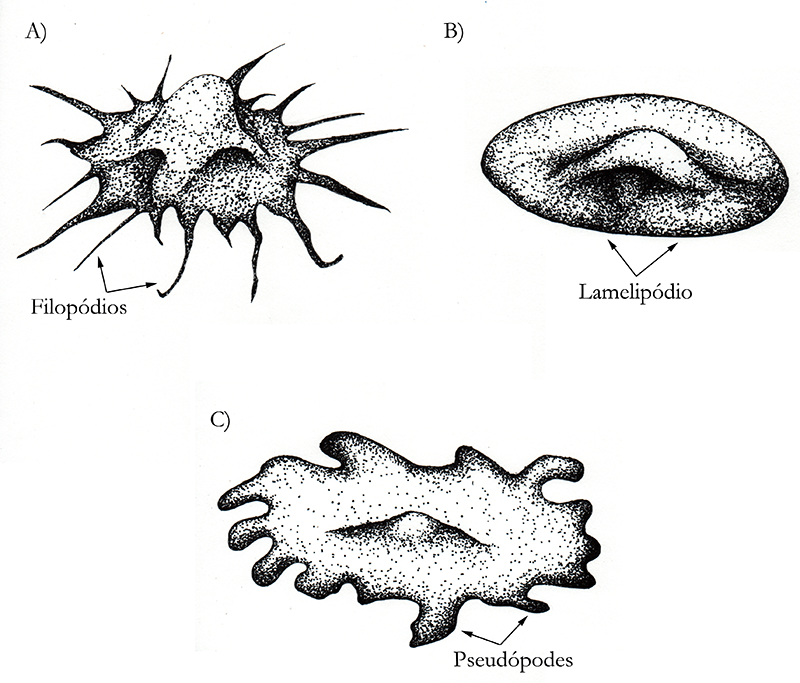
Os filopódios são formados por um núcleo de filamentos de actina que se alonga em uma direção única, estendendo a membrana plasmática como um fio. São estruturas formadas, por exemplo, por fibroblastos.
Os lamelipódios são formados por redes de fibras de actina que são polimerizadas paralelamente ao substrato, dando a esta projeção um aspecto de um leque que se espalha sobre uma superfície plana. Este tipo de protrusão é observado em fibroblastos e células epiteliais.
Os pseudópodes são muito conhecidos nas amebas, que emitem projeções em suas membranas para capturar alimento e se locomover. Este tipo de protrusão da membrana plasmática também é observado em neutrófilos, que são células do sistema imune. Os pseudópodes são preenchidos por um gel de filamentos de actina.
Devido às suas características, os lamelipódios são mais bem estudados em microscopia do que os demais tipos de protrusão descritos acima, mas acredita-se que os mecanismos gerais descritos a seguir também sirvam para os outros tipos de protrusões, guardadas as devidas particularidades.
Estudos com células epiteliais de peixes e anfíbios, conhecidas como queratócitos, permitiram elucidar detalhes da migração celular por meio de lamelipódios. Essas células em cultura assumem uma aparência de leque, com um grande lamelipódio em arco espalhando-se sobre o substrato no sentido do deslocamento, arrastando uma pequena porção da célula onde está o núcleo (Figura 3).
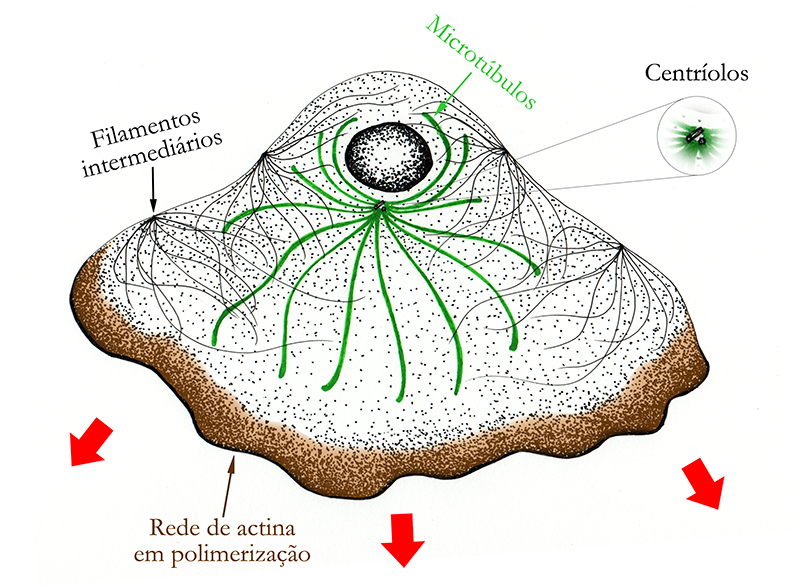
Figura 3 – Esquema simplificado de um queratócito em migração, através da formação de um lamelipódio. Essas células em cultura, vistas de cima, adquirem um aspecto parecido ao representado na figura. As setas vermelhas indicam o sentido de expansão do lamelipódio e, consequentemente, o sentido de migração da célula. A rede de actina está presente por toda a célula, porém no esquema só foi representada, em marrom, a região onde a rede de actina sofre uma polimerização mais intensa. Baseado em Alberts et al, 2011. (Créditos: Arthur Tributino Menezes; ilustrado por: Bruna Afetian Sollitto)
Os queratócitos migram realizando as etapas vistas anteriormente todas ao mesmo tempo, de modo que não são observadas alterações em sua morfologia ao longo do deslocamento. Basicamente, redes ramificadas de fibras de actina, interagindo com outros elementos, são polimerizadas no sentido do movimento da célula, na borda anterior do lamelipódio. Ao mesmo tempo, a parte posterior dessa rede vai sendo desfeita, de modo que o crescimento dessa rede na parte anterior impulsiona a protrusão da membrana do queratócito em forma de leque no sentido do movimento.
As próximas etapas do movimento, como mencionado anteriormente, são a adesão da protrusão da célula a um determinado ponto no substrato e a tração da parte posterior da célula no sentido do movimento. Durante a migração celular, há uma intensa interação de elementos do citoesqueleto com o sistema de adesão da célula e o substrato circundante, que pode ser, por exemplo, matriz extracelular. Através de adesões celulares, a célula vai ancorando a sua protrusão ao mesmo tempo em que a estende. Esse é um processo dinâmico, de modo que a célula vai aderindo ao substrato em certas regiões e se desprendendo em outras, ao longo de seu deslocamento.
A tração da porção posterior da célula é feita com o auxílio de proteínas motoras miosina II, as quais promovem uma contração da parte posterior da célula tracionando-a para o sentido do movimento, apoiado nos pontos de ancoragem da protrusão anterior no substrato. Assim, a contração da parte posterior da célula impulsiona o citoplasma para dentro das protrusões citoplasmáticas na porção anterior, e toda a célula, assim, se desloca. Além disso, acredita-se que a ação da miosina II promova a despolimerização dos filamentos de actina na porção posterior da célula, de modo a disponibilizar de forma mais eficiente os monômeros para a polimerização dos mesmos filamentos na região. A força de extensão, promovida na parte anterior da célula pelo deslocamento do citoplasma, também facilita a polimerização das fibras de actina na porção anterior da rede.
A interação da célula em migração com o ambiente circundante é mais complexa do que as etapas que foram descritas acima de forma sucinta. Tal interação também determina, por exemplo, o direcionamento e polarização da célula, processos fundamentais para orientar corretamente o seu movimento e a sua chegada ao local onde ela é necessária.
Assim, elementos do meio extracelular sinalizam para a célula a direção na qual ela deve migrar. Para exemplificar, consideremos a migração de um neutrófilo para um local de inflamação, por quimiotaxia. A presença de bactérias em uma lesão irá liberar substâncias estranhas no organismo infectado, a partir do local da lesão. Essas substâncias podem ser reconhecidas por receptores na superfície de um neutrófilo circulante. Tal reconhecimento promove um rearranjo em elementos do citoesqueleto do neutrófilo, reorientando a sua polarização e dirigindo a dinâmica de polimerização das fibras de actina do citoesqueleto, de modo que a célula se desloque na direção do sinal químico emitido pela presença das bactérias. Dessa forma, o neutrófilo é capaz de chegar ao local da lesão, fagocitar as bactérias aí presentes e em seguida destruí-las.
Proteínas da família Rho na migração celular
Como vimos até aqui, a migração celular envolve diferentes mecanismos que se intercomunicam no interior da célula. Durante esse processo, o ambiente intracelular é reorganizado de modo que a célula fica polarizada, ou seja, uma de suas extremidades apresenta estruturas e processos diferentes da outra. Tal organização é feita principalmente pela ação de elementos do citoesqueleto, o qual está em constante comunicação com o meio que circunda a célula através de elementos presentes na membrana plasmática. Assim, sinais extracelulares irão interferir na dinâmica de polimerização da rede de actina intracelular. Tais sinais são recebidos pela célula por diferentes vias, convergindo em GTPases monoméricas da família da proteína Rho. São elas a Cdc42, a Rac e a Rho.
Estas proteínas funcionam como interruptores intracelulares, sendo que podem estar ativas ou inativas, dependendo de seu estado de ligação a GTP (ativas) ou GDP (inativas).
Essas três GTPases participam de cascatas de reações interagindo com diversas proteínas alvo, e dessa forma têm um papel importante na dinâmica do interior da célula durante a migração.
Quando Cdc42 é ativada, ocorre a indução da polimerização de actina na formação de filopódios e outras estruturas conhecidas como microespículas, que são pequenas protrusões celulares. Desse modo, a ativação de Cdc42 leva a um aumento da nucleação de actina, ou seja, leva a um aumento da formação de dímeros e trímeros para a construção das redes de actina.
A ativação de Rac irá induzir a polimerização de actina principalmente na periferia celular, o que leva a formação de lamelipódios. Além disso, essa ativação também inibe a atividade contrátil da proteína motora miosina II, de modo a estabilizar o lamelipódio.
Já a ativação de Rho induz a produção de feixes de actina com miosina II. Diferentemente do que fazem a Cdc42 e a Rac, a ativação de Rho induz a formação de feixes paralelos de actina, e também ativa uma proteína-cinase que acaba por inibir a atividade de uma proteína conhecida como cofilina. A inibição dessa proteína garante a estabilização dos filamentos de actina.
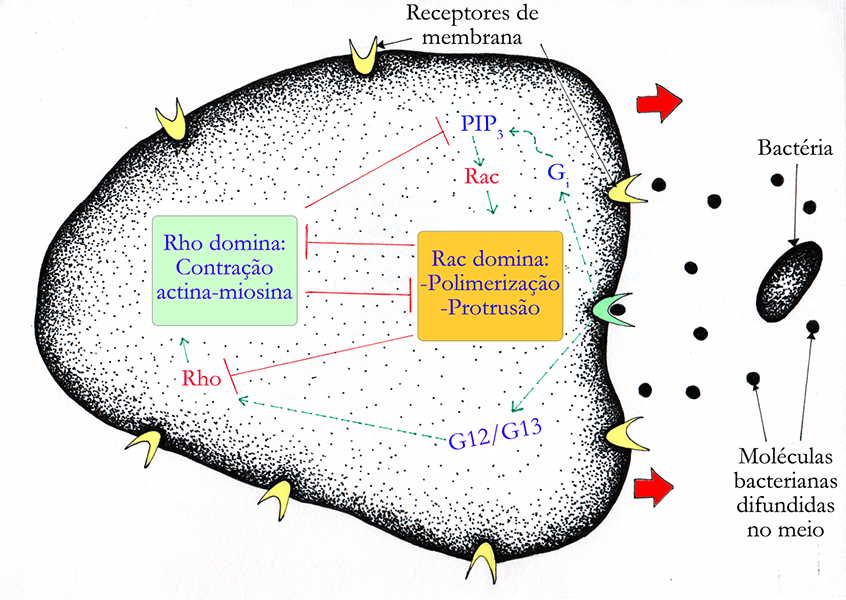
Como citado anteriormente, sinais extracelulares podem definir o direcionamento da migração celular, e nesse processo há a participação de algumas dessas proteínas da família Rho. A figura 4, abaixo, mostra de forma simplificada como as proteínas Rac e Rho atuam em vias que direcionam um neutrófilo para o local onde há uma bactéria, a qual ele deve capturar e destruir.
Figura 4 – Esquema geral da polarização de um neutrófilo induzida por uma bactéria, por intermédio das GTPases Rac e Rho. A bactéria libera moléculas no meio que são reconhecidas por receptores na membrana do neutrófilo. A ligação dessas moléculas ao receptor disparam vias que envolvem a Rac e a Rho. Rac promove a polimerização da rede de actina no sentido do movimento, enquanto Rho estimula a contração da parte posterior da célula. As setas verdes indicam estímulos, e as linhas vermelhas indicam inibição. Como ilustra a imagem, a polarização da célula consiste na predominância da ação de Rac na parte anterior e de Rho na parte posterior. Assim, onde Rac domina, Rho está inibida, e vice-versa. As setas vermelhas indicam o sentido do movimento da célula. (Créditos: Arthur Tributino Menezes; ilustrado por: Bruna Afetian Sollitto)
Migração de células em conjunto
A migração coletiva de células é recorrente em processos como o desenvolvimento embrionário, a cicatrização de feridas e a regeneração de tecidos. Além disso, este tipo de migração também é observado em metástases de câncer epitelial.
As células em migração coletiva usam mecanismos semelhantes aos discutidos acima para células individuais, porém irão apresentar uma série de mecanismos decorrentes do fato de estarem associadas em conjuntos. Assim, elas apresentam mecanismos para: manter a coesão e organização tecidual; regular a permeabilidade paracelular; criar gradiente de fatores solúveis; distribuir tarefas entre células móveis e não móveis que fazem parte do grupo; propagar sinais mecânicos via junções celulares; e, no caso de metástases, proteger o grupo de células do ataque do sistema imune.
A transição do estado estático para o estado móvel, pelo qual passam grupos de células durante o desenvolvimento embrionário, cicatrização de feridas e metástases, pode ser em parte entendida pelo mecanismo de transição epitélio-mesenquimal (TEM).
A TEM é um programa celular altamente conservado, caracterizado por modificações morfológicas, estruturais e moleculares sofridas pelas células, incluindo: o achatamento da célula, perda de polaridade apico-basolateral e contatos celulares, formação de uma protrusão dinâmica na borda anterior e alta concentração de filamentos intermediários. Tal processo ilustra bem o que ocorre na migração de células da crista neural e gastrulação da mesoderme durante o desenvolvimento embrionário.
Além do mecanismo de TEM mencionado acima, as células em migração coletiva contam com outros mecanismos, de modo que podem migrar em grupos por grandes distâncias mantendo a coesão entre si. Assim, as células não estão restritas ao modelo de TEM mencionado, mas podem combinar os diferentes mecanismos para otimizar a migração, o que não seria possível em células que migram individualmente.
MicroRNAs, câncer e a migração celular
MicroRNAs são RNAs não codificadores (ou seja, não codificam a produção de uma proteína, como o fazem os RNAs mensageiros) produzidos no núcleo das células. Essas moléculas têm sido bastante estudadas nas últimas décadas devido ao seu papel na regulação de diversos processos intracelulares. De um modo geral, os microRNAs atuam controlando a tradução de RNAs mensageiros específicos, de maneira direta ou indireta.
Mas o que isso tem a ver com migração celular?
Anteriormente vimos o papel regulatório de algumas GTPases da família da proteína Rho na migração celular. Alguns microRNAs podem ter como alvo algumas destas proteínas. Assim, podemos imaginar uma situação em que um organismo passe a superexpressar algum destes microRNAs, devido a, por exemplo, uma condição patológica. A migração celular nesse indivíduo seria afetada por essa explosão de microRNAs, e com as informações que temos até aqui, poderíamos especular sobre quais seriam as consequências disso. Podemos pensar, por exemplo, que esse indivíduo desenvolva problemas para a cicatrização de feridas, já que este processo é altamente dependente da migração de células. De fato, há estudos que buscam entender os mecanismos que afetam a migração celular em modelos diabéticos, dada a conhecida dificuldade de cicatrização de feridas apresentada por pessoas que apresentam tal patologia.
Há também estudos que relacionam microRNAs específicos com moléculas envolvidas na migração celular em modelos de câncer. O microRNA mir-31, por exemplo, é conhecido como um microRNA antimetastático em câncer de mama, ou seja, a sua expressão promove uma redução da migração de células tumorais, o que reduziria as chances de essas células espalharem-se pelo corpo do paciente. Tais estudos são particularmente interessantes para o desenvolvimento de novos fármacos, os quais poderiam auxiliar no tratamento de pacientes com câncer. No entanto, ainda há muito para ser estudado no universo dos microRNAs e seus mecanismos de ação, para que no futuro possam ser desenvolvidos medicamentos seguros e eficazes.
Links interessantes!
• Estudo identifica microRNA relacionado com a migração de tumores.
Disponível em: <https://agencia.fapesp.br/estudo_identifica_microrna_relacionado_com_a_migracao_de_tumores/20194/>.
Acesso em: 03/02/17.
• Vídeo mostrando de forma resumida as etapas da migração de uma célula sobre um substrato.
• Vídeo falando um pouco sobre a migração celular em geral.
Além do mecanismo de migração que vimos, neste vídeo o autor menciona outro mecanismo que pode ser empregado pelas células no deslocamento.
• Vídeo mostrando a perseguição e captura de uma bactéria por um glóbulo branco.
Referências
Livros
• Alberts, B. et al. 2011. Biologia Molecular da célula. 5ª ed. Artmed
• Pollard, et al. 2006. Biologia celular. 1ª ed. Elsevier.
Artigos
• Bouchet B, Akhmanova A. Microtubules in 3D cell motility. Journal of cell science. 2017. Disponível em: <http://jcs.biologists.org/content/130/1/39.article-info>.
Acesso em: 03/02/17.
• C.R. Lima, M.V. Geraldo, C.S. Fuziwara, E.T. Kimura, M.F. Santos. MiRNA-146b-5p upregulates migration and invasion of different papillary thyroid carcinoma cells. BMC Cancer, 16 (2016), p. 108. Disponível em: <http://bmccancer.biomedcentral.com/articles/10.1186/s12885-016-2146-z>.
Acesso em: 03/02/17.
• Müller J, Sixt M. Cell migration: making the waves. Current Biology. 2017. Disponível em: < http://www.sciencedirect.com/science/article/pii/S0960982216313884>.
Acesso em: 03/02/17.
• Mulrane L, Gallagher WM, O’Connor DP. A novel mechanism of regulation of the anti-metastatic miR-31 by EMSY in breast cancer. Breast Cancer Research : BCR. 2014;16(6):467. doi:10.1186/s13058-014-0467-x. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4429417/>.
Acesso em: 03/02/17.
• Trepat X, Chen Z, Jacobson K. Cell Migration. Comprehensive Physiology. 2012;2(4):2369-2392. doi:10.1002/cphy.c110012. Disponível em: <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4457291/>.
Acesso em: 03/02/17.
