Dra. Cilene Rebouças de Lima
Introdução
As células são as unidades básicas dos seres vivos, e sua capacidade de realizar várias funções imprescindíveis para o crescimento, desenvolvimento e manutenção de um ser é sensacional. Sabe-se ainda que cada uma delas, seja membro de organismos unicelulares ou pluricelulares, vive em diferentes ambientes, que por sua vez, são capazes de influenciar o comportamento celular.
Em seres pluricelulares, desde os mais simples até os que apresentam alto grau de complexidade, são formados por vários tipos celulares organizados em diferentes níveis. Em nível tecidual, as células estão imersas em um ambiente constituído por vários tipos moleculares, denominado matriz extracelular. A integração entre as atividades celulares e o microambiente ao seu redor (produzidos pelas próprias células), é primordial para as funções tecido-específicas e para todo o organismo.
Os estudos da matriz extracelular e sua integração com as atividades celulares são relativamente recentes. Os cientistas vêm descobrindo novas funções/importância dos componentes da matriz sobre as funções celulares, de modo a elucidar que a matriz não tem somente papel de suporte mecânico às células.
Será apresentado a seguir, os principais componentes da matriz extracelular e algumas funções e importância dos diferentes microambientes.
Matriz extracelular: composição molecular e organização
O microambiente celular – denominado matriz extracelular – é formado por uma grande variedade de macromoléculas. Estas são secretadas por células em proporções variáveis, dando origem a uma rede bem organizada. Esta matriz pode ser encontrada ao redor das células em composições variadas no tecido conjuntivo, formando assim, a denominada “matriz extracelular intersticial” para atender as necessidades dos vários tipos celulares, e ainda há uma forma especializada presente entre o tecido epitelial e o tecido conjuntivo, denominada membrana basal. Em ambos os casos, as moléculas presentes podem ser agrupadas em três grupos:
- Proteínas multiadesivas;
- Proteínas estruturais fibrosas;
- Proteoglicanos/glicosaminoglicano.
Membrana basal
A membrana basal, como dito anteriormente, localiza-se entre tecido epitelial e conjuntivo, com função principal de unir estes tecidos. Embora seja encontrada em maiores proporções entre estes tecidos, está presente em outros locais, como por exemplo, ao redor de células musculares, adiposas e células de Schwann.
Ela é basicamente formada por duas lâminas: lamina basal e lâmina reticular (Figura 1). A ultraestrutura da lâmina basal, por sua vez, é formada por duas camadas – a mais próxima do tecido epitelial é denominada lâmina rara ou lúcida e, mais abaixo, a lâmina densa, que está em contato direto com a lâmina reticular.
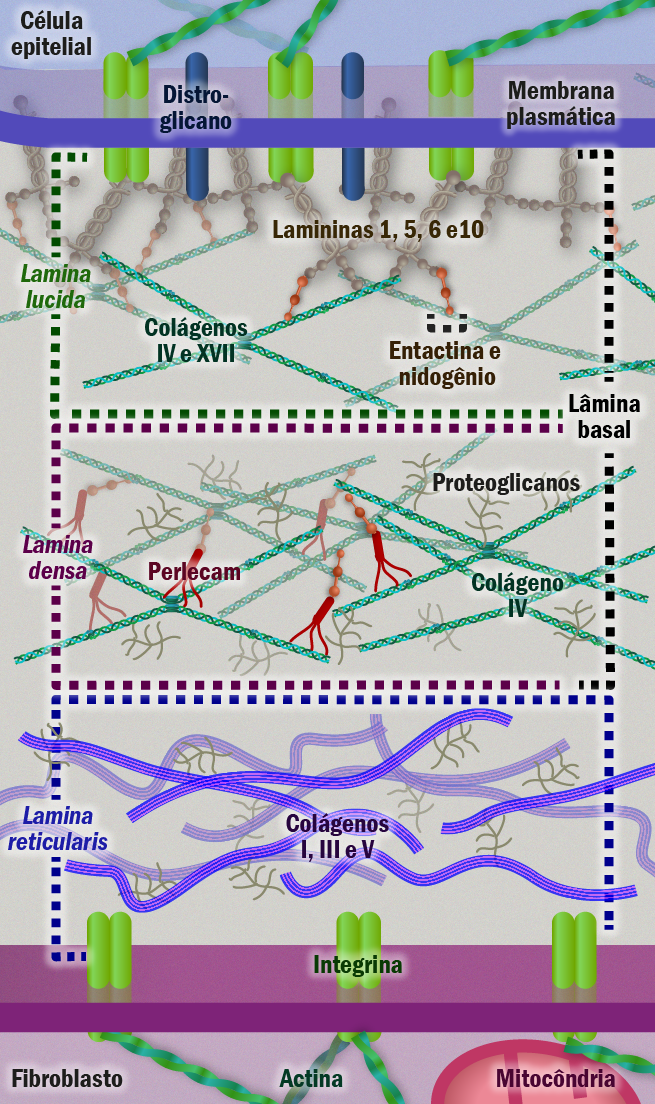
Figura 1 – Esquema da membrana basal. Esquema da membrana basal subjacente ao epitélio celular típico ou endotélio vascular que consiste de duas camadas estruturais – lamina basal e lamina reticular. Menter, D.G. & DuBois, R. N. (2012) – Prostaglandins in Cancer Cell Adhesion, Migration, and Invasion – review article, International Journal of Cell Biology – doi:10.1155/2012/723419 – Ilustração: Edilson Jacob
Embora sua composição seja variável nos tecidos, sendo identificado mais de 50 tipos de moléculas diferentes, os principais componentes presentes são laminina, colágeno tipo IV, proteoglicanos (principalmente perlecam) e entactina. Esta rede se dispõe como um tapete molecular ancorado ao tecido conjuntivo através de receptores celulares. Entre eles estão as integrinas e os proteoglicanos de superfície celular (ex. sindecans).
Componentes da membrana basal
Lâmina basal
Laminina
A laminina é o principal componente da lâmina basal. Faz parte do grupo das proteínas multiadesivas, formadas por três cadeias polipeptídicas (α, β e ɣ) unidas por ligações dissulfeto, que se enovelam em forma de cruz – proteína heterotrimérica (Figura 2). Até o momento presente, são conhecidas 16 isoformas.
Figura 2 – Representação esquemática da estrutura da laminina. (A) A laminina é formada por três cadeias polipeptídicas trançadas entre si formato de cruz, onde cada cadeia apresenta regiões de ligação com diferentes moléculas (B) Eletromicrografia de laminina. Figura baseada nos livros Biologia Molecular da Célula, 5 ed (Figura 19-42) e Biologia Celular – Bases moleculares e metodologia de pesquisa, 1 ed (Figura 8.3). Créditos: Edilson Jacob

Estas macromoléculas são capazes de interagir entre si e também com outros componentes da matriz tais como colágeno IV, entactina, proteoglicanos de heparam sulfato como perlecam. Sua capacidade de interagir com receptores celulares destaca seu importante papel não só na ancoragem da membrana basal ao tecido adjacente, como também na sua capacidade de desencadear a ativação de diferentes vias de sinalização celular e assim, influenciar várias funções celulares como por exemplo, proliferação, diferenciação e migração celular, tanto em processos fisiológicos como em processos patológicos, (Domogatskaya et. al., 2012). Para exemplificar, recentemente descobriu-se que a expressão de laminina-551 tem associação direta com a progressão e a metástase em câncer de mama.
Colágeno
Outro importante componente estrutural da lâmina basal é o colágeno IV, que pertence à família de proteínas mais abundante em mamíferos. Embora existam inúmeros tipos de colágeno (mais de 25 tipos), todos são formados por cadeias polipeptídicas triplas, denominadas cadeias α, que se entrelaçam umas as outras, originando uma corda contorcida de estrutura estável. Esta estabilidade se dá graças à presença de grandes quantidades de três aminoácidos: glicina (33,5%), prolina (12%) e hidroxiprolina (10%). Os colágenos podem ser encontrados em duas formas – em fibras ou em redes bidimensionais, como é o caso do colágeno IV.
Todas as isoformas de colágeno IV conhecidas são formadas pela combinação de seis tipos diferentes de cadeias α. Cada cadeia é estruturalmente formada por três domínios: domínio amino-terminal 7S, domínio intermediário e domínio globular carboxi-terminal NC-1 (non-collagenous). De forma geral e simplificada, a montagem da rede bidimensional tem início na interação de três cadeias α através de seus domínios globulares NC-1, entrelaçando-se até o domínio 7S. A estrutura formada é denominada protômero. A seguir, dois protômeros se associam via domínios globulares (NC-1), formando um dímero. Formam-se a seguir tetrâmeros pela ligação da região amino-terminal 7S. As interações destes tetrâmeros originam a ultraestrutura em forma de rede do colágeno IV na membrana basal (Kalluri, 2003) (Figura 3).
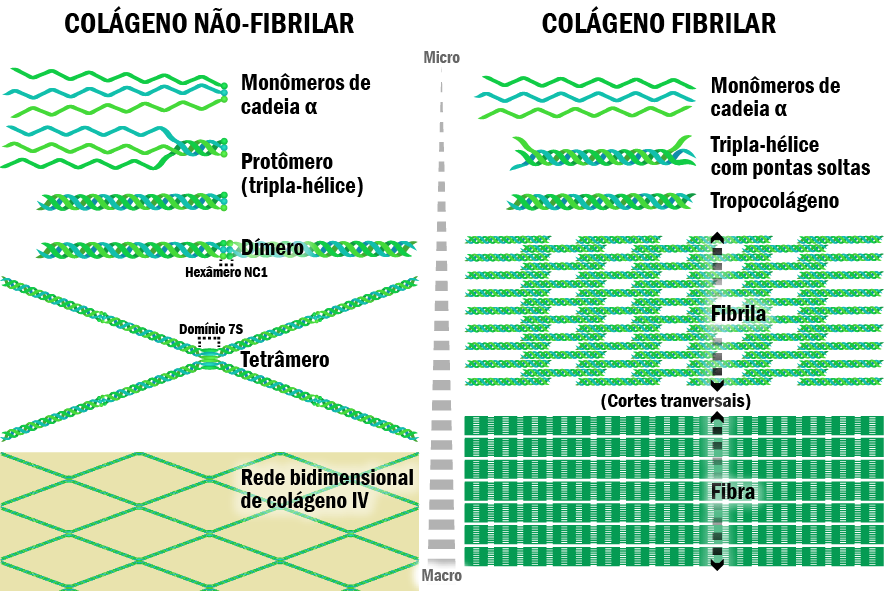
Figura 3 – Organização supramolecular das moléculas de colágeno. Figura baseada em Kalluri, R. (2003) – Basement membranes: structure, assembly and role in tumour angiogenesis. Nature Reviews Cancer 3, 422-433 – Box 1: Type IV collagen network formation e Biologia Celular – Bases moleculares e metodologia de pesquisa, 1 ed (Figura 8.5). Créditos: Edilson Jacob
O colágeno IV é também capaz de interagir com outras moléculas da membrana basal (lamininas, entactina, perlecam) e com receptores celulares (ex. integrinas) por possuir diferentes domínios de ligação em sua estrutura (Figura 4).
Figura 4 – Colágeno tipo IV com outros componentes da membrana basal e com integrinas. Baseado em : Kalluri, 2003 – Nature Reviews Cancer, Figure 4 (https://www.nature.com/nrc/journal/v3/n6/fig_tab/nrc1094_F4.html).

Entactina (nidogênio)
Outra proteína presente na lâmina basal é a entactina, também conhecida como nidogênio. É uma pequena glicoproteína sulfatada (150kDa), que possui três domínios globulares e uma região mais longa em forma de bastão. Nestes domínios existem sítios de ligação para laminina, colágeno tipo IV e perlecam formando um complexo estável, de modo a contribuir na organização e arquitetura da membrana basal. Outras funções para esta molécula ainda não foram estabelecidas.
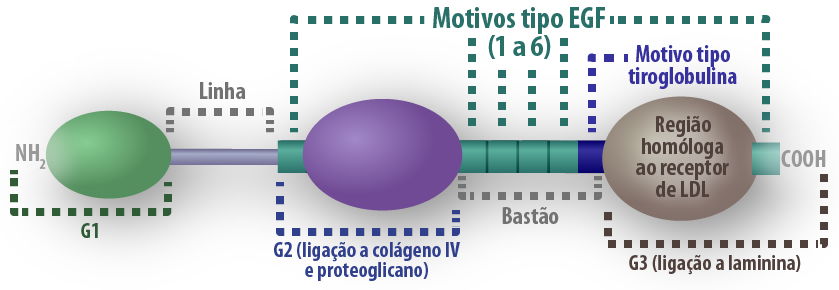
Figura 5 – Estrutura do nidogênio. Fonte: manual de bioquímica com correlações clínicas, Devlin, 6ed figura 9.45. Créditos: Edilson Jacob
Proteoglicanos de lâmina basal
Além dos componentes já descritos, também são encontrados na membrana basal proteoglicanos. O mais conhecido e estudado é o perlecam.
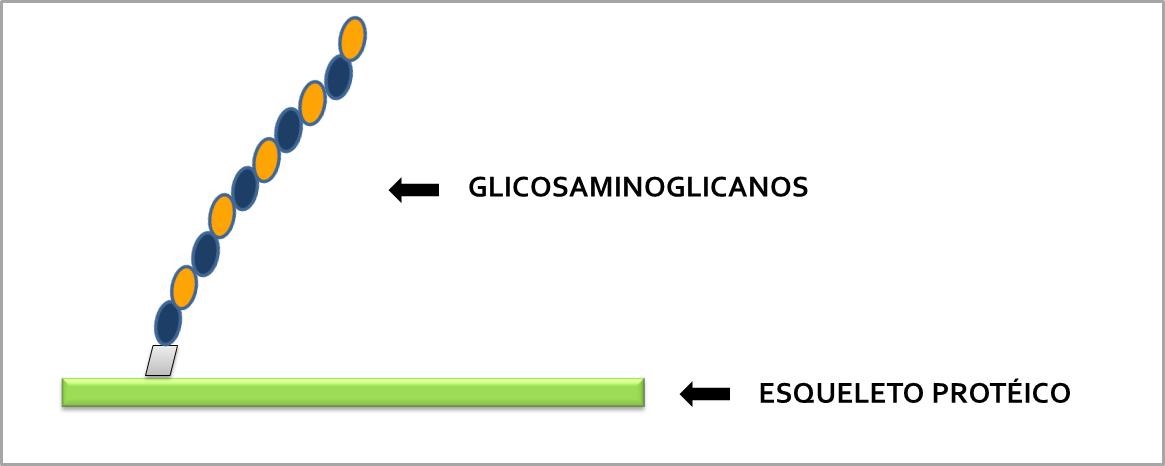
Os proteoglicanos são macromoléculas constituídas por um esqueleto proteico ao qual estão covalentemente ligadas uma ou mais cadeias de glicosaminoglicanos (GAGs). Estes são polissacarídeos lineares formados por unidades dissacarídicas repetitivas (uma hexosamina e um ácido urônico) unidos por ligações glicosídicas intra e inter-dissacarídicas, nos quais estão presentes de grupamentos carboxila e sulfato em diferente posições, o que confere a estas moléculas uma alta densidade de carga aniônica (Figura 6). São comumente conhecidos 6 tipos de GAGs em mamíferos: condroitim sulfato (CS), dermatam sulfato (DS), heparam sulfato (HS), queratam sulfato (KS), heparina (HEP) e ácido hialurônico (AH). Este último, atualmente conhecido com hialuronam é o único que não ocorre ligado a uma proteína.
Figura 6 – Esquema da esturtura dos proteoglicanos presentes nos tecidos de seres vivos.
O perlecam é um proteoglicano de heparam sulfato (Figura 5), cujo nome foi dado por apresentar-se com um “colar de pérolas” à microscopia eletrônica. Apresenta em seu esqueleto protéico cinco domínios distintos capazes de se ligar a outras proteínas de matriz extracelular, de superfície celular, fatores de crescimento e ainda a moléculas de adesão, mostrando sua importante participação em várias funções celulares e na própria membrana basal. Um órgão muito rico em perlecam é o rim, especialmente o glomérulo renal, por ser rico em membrana basal (membrana basal glomerular). Estudos mostraram que os proteoglicanos (especialmente perlecam) presentes na membrana basal parecem ter um papel fundamental neste processo de filtração glomerular, já que após a remoção de cadeias glicosaminoglicanos pela ação de enzimas específicas, ocorreu à perda significativa de suas propriedades filtrantes.
Lâmina reticular
A lâmina reticular contém outros tipos de colágenos, especialmente tipo III, além dos tipos I e IV e vários proteoglicanos. As fibras reticulares são fibras extremamente finas, com diâmetros entre 0,5 e 2µm, que formam uma rede extensa, frouxa e flexível. São formadas predominantemente por colágeno tipo III associadas a uma grande quantidade de açúcares (cerca de 6 a 12% de hexoses), especialmente glicoproteínas e proteoglicanos.
Estas fibras não são visíveis em preparados corados por hematoxilina-eosina, mas podem ser visualizadas por impregnação com sais de prata na cor preta. Em função desta característica são chamadas de fibras argirófilas.
Quando observadas ao microscópio eletrônico, estriações transversais são observadas em cada fibra como ocorrer para os demais tipos de colágenos. Estas fibras mostram-se em uma rede frouxa, unidas por pontes formadas pelos açúcares.
Como dito anteriormente, a função inicialmente descrita para a membrana basal foi a de conectar o tecido epitelial ao tecido conjuntivo, porém outras funções já são descritas, como por exemplo, sua importante participação no processo de filtração renal, no processo de regeneração tecidual, entre outros. À medida que os conhecimentos progridem, especialmente no que se refere às funções dos componentes da membrana basal sobre os processos celulares, novas funções são descobertas.
