Isaias Cavalcante de Oliveira
Introdução
Importantes avanços no conhecimento sobre estrutura, diferenciação e funções celulares, envolvem não só a observação das células no microscópio, mas também sua manipulação e cultivo. Células de diferentes organismos podem ser cultivadas, desde os menores como as bactérias e certos fungos, a organismos maiores como répteis e mamíferos e até mesmo plantas. Essa área de estudo tem ganhado destaque quando falamos de biotecnologia, terapia celular e medicina regenerativa. Mas, como funciona e qual a finalidade de uma cultura celular?
A cultura celular envolve um conjunto de técnicas que mantém vivas células fora de seu “ambiente natural”. Consiste em mimetizar condições ideais, para que as células possam ser mantidas, semelhante ao seu ambiente (tecido, órgão, organismo) de origem. As células são cultivadas a partir de um substrato ou meio de cultura que fornece os nutrientes essenciais (como aminoácidos, carboidratos, vitaminas, minerais), fatores de crescimento, hormônios, gases (CO2 e O2) e também o ambiente físico-químico ideal (pH, luz, temperatura), podendo estes fatores variarem de acordo com o tipo celular cultivado. Tais culturas podem ser úteis para o estudo e a produção de anticorpos, vacinas, enzimas, hormônios e outros. As técnicas de cultivo nos permitem entender processos tais como a comunicação celular, como medicamentos e outras substâncias atuam em nosso corpo e também como ocorre a sua produção por estas células, sendo inclusive uma alternativa ao uso de animais em pesquisas, na propagação e produção de metabólitos por plantas, no entendimento de doenças e terapia celular ou com células-tronco, por exemplo, ou até na produção de alimentos, entre outras possibilidades.
História
Os primeiros estudos com culturas de células remontam ao começo do século XX com Harrison (1870–1959) e Loeb (1869–1959), que usavam tecidos ou pedaços de órgãos mantidos vivos em tubos de ensaio com fluidos dos próprios animais ou soluções salinas como meio líquido. Harrison estudava como as fibras nervosas de sapos se desenvolviam, a partir de células precursoras (neuroblastos), cultivando o tecido no tubo de ensaio. Ele observou que as protuberâncias das células nervosas exibem movimento citoplasmático. Foi bem engenhoso, se preocupando em manter a cultura livre de contaminação e também na escolha do modelo animal, não precisando controlar a temperatura, já que os anfíbios são animais cuja temperatura interna varia com a do ambiente (ectotérmicos).
Em seguida, Alexis Carrel (1873–1944) aprimorou as metodologias de Harrison enquanto estudava fragmentos de tecidos normais e tumorais de galinha e mamíferos. Ele e seu colega Burrows (1884–1947) cultivaram esses tecidos no plasma do animal de origem, suspendendo-os em gotas, assim como em lâminas em placas de vidro, tendo sucesso na transferência de células para novas placas. Entre suas contribuições estão a invenção dos primeiros frascos de cultura, semelhantes aos que temos hoje, e reconhecer a necessidade de trocar a fonte de nutrientes nos frascos, mostrando que o soro de diferentes mamíferos poderia ser usado em vez de plasma, possibilitando maior crescimento celular. Basicamente, o soro é o líquido restante depois que os fatores de coagulação são removidos do plasma sanguíneo. Também se preocupava com o desenvolvimento de técnicas de assepsia.
Carrel também era muito próximo de Charles Lindbergh (1902-1974), e ambos colaboraram juntos em muitos trabalhos de pesquisa na década de 1930. Lindbergh foi um piloto norte-americano, famoso por ter sido o primeiro piloto a atravessar o Oceano Atlântico sem escalas em seu avião Spirit of St. Louis, partindo dos Estados Unidos rumo à França. Ele também foi um pesquisador bastante interessado no avanço da tecnologia médica, desenvolvendo alguns métodos de separação entre soro e sangue também introduzindo uso de frascos de cultura de tecidos (Pyrex®) bastante resistentes ao calor, permitindo a autoclavagem para esterilização. Sua vida tem bastante controvérsias, mas deixo para você pesquisar depois.
Os anos foram se passando e muitas pesquisas foram surgindo. Em 1951, George Gey cultivava células HeLa, Hayflick e Moorhead em 1961 pesquisavam células diplóides humanas e senescência celular. Em 1962, Nakamura e colaboradores, no Japão, estabeleceram a linhagem VERO, a partir do rim de macaco-verde africano (Cercopithecus aethiops), sendo atualmente uma das poucas linhagens aprovadas para uso em produção de vacinas pela Organização Mundial da Saúde (OMS). Wilton Earle colaborou com outros meios para o cultivo de células. Raymond C. Parker estudou o vírus da poliomielite e a vacinação. Entre muitos outros.
Cultura celular primária e secundária
A cultura celular primária envolve a coleta de pequenas amostras (biópsia) de diversos tecidos (músculos, sangue, epitélio, etc.), órgãos (coração, pele, fígado, rins, baço entre outros) ou organismos (embriões) em condições assépticas com ou sem a separação dessas células, etapa na qual a matriz extracelular e junções que as unem são rompidas, mecânica, química (com o uso de EDTA, por exemplo) ou enzimaticamente (com tripsina e colagenase, enzimas que quebram certos tipos de ligações peptídicas ou certas proteínas ). Posteriormente, as células são diluídas e eventualmente centrifugadas (sedimentadas), sendo transferidas para recipientes e meios de cultura. As culturas primárias são aquelas mais parecidas com as células dos tecidos de origem, embora possam apresentar uma população heterogênea e baixa taxa de proliferação.
Conforme as células se multiplicam (e algumas fazem isso bem rápido!), os nutrientes e substâncias necessárias ao seu desenvolvimento são consumidos mais rapidamente, o que leva a uma diminuição de seu espaço de proliferação no ambiente de cultivo. Desse modo, é necessário que parte dessas células sejam transferidas para um novo ambiente de cultura em condições apropriadas, para continuarem a se multiplicar. Esse método é conhecido como passagem (passaging, em inglês). Nesse momento, para alguns autores, tais culturas já podem ser chamadas de culturas secundárias. Durante o cultivo é comum adicionar certos fatores de crescimento que vão favorecer a multiplicação de tipos celulares desejados. As células normais cultivadas em geral não conseguem se multiplicar indefinidamente e após algumas divisões perdem sua capacidade de proliferarem e sobreviverem devido a certas condições que ocorrem naturalmente ou patologicamente, semelhantes aos eventos fisiológicos nos organismos, como envelhecimento celular e apoptose (morte celular programada). Portanto, a maioria dessas células primárias colocadas em cultura irão morrer e não darão origem a linhagens contínuas como veremos a seguir.

Figura 1 – Cultura celular primária e secundária. (Crédito: Isaias Cavalcante de Oliveira)
Células aderentes e não aderentes
De um modo geral, as células proliferam por divisão celular até que cubram toda a superfície do recipiente de cultura, aderindo-se a ele, e como vimos, essa característica depende do espaço livre no recipiente de cultura e da quantidade de nutrientes que o meio oferece. O momento ideal da passagem acontece quando ~80% da cultura está preenchida (o que é conhecido como confluente). O tempo desde a última passagem e outros procedimentos, como contagem das células, devem ser levados em consideração, assim como o tipo celular cultivado. Células provenientes de órgãos e/ou tecidos rígidos apresentam maior adesão ao substrato (mediadas por junções celulares) quando comparadas a células sanguíneas, por exemplo, que se encontram em suspensão no nosso organismo. Sabe-se que a adesão é mediada por cargas negativas presentes no recipiente de cultura, pois essas cargas desencadeiam a produção de proteínas de adesão e proteoglicanos pelas células para que elas se fixem na superfície.
Há também células não aderentes que não precisam se fixar para se proliferar ou sobreviver, permanecendo em suspensão, bem características de células sanguíneas ou de tecido tumoral. Ainda, existem algumas poucas linhagens que podem ser cultivadas dos dois modos, como as células SH-SY5Y , originárias de neuroblastoma humano (confira a tabela 1 abaixo)..

Figura 2 – Células SH-SY5Y cultivadas em uma placa de 384 micropoços. A imagem faz parte de um time-lapse que foi adquirido usando ampliação de 20x e contraste de fase. A imagem foi obtida em microscopia de contraste de fase de luz transmitida com ZEISS Celldiscoverer 7 ®. Observe a morfologia. Ao longo da diferenciação essas células deixam de apresentar um fenótipo mais “plano” e começam a ter um aspecto mais estrelado, com muitas projeções (neuritos). Imagem sob licença CC BY 2.0 | Fonte. Autoria: P. Denner, Core Research Facilities, German Center of Neurodegenerative Diseases (DZNE), Bonn, Alemanha.
Linhagem celular imortalizada (contínua) e cultura transformada
Ao longo do tempo, células com uma maior capacidade de se multiplicar acabam predominando no meio de cultura e se mostram mais adaptadas aos processos sofridos durante o seu cultivo. Essas células que ainda conservam certas características do tecido de origem e possuem capacidade de se dividir sem ativar processos que levem a seu envelhecimento celular e apoptose, conforme discutido anteriormente, são conhecidas como uma linhagem celular estabelecida ou imortalizada. No entanto, devido a esta característica, eventualmente podem acabar sendo mais suscetíveis a alterações morfológicas e apresentam maior suscetibilidade a certas anomalias nos cromossomos.
Existe também a possibilidade de que algumas alterações genéticas, com consequente mudanças nas características das células, aconteçam e elas podem deixar de serem semelhantes – tanto do ponto de vista morfológico quanto do ponto de vista genético – ao tecido de onde vieram e sendo denominadas células transformadas. Podem ser transformadas ao acaso em cultura ou utilizando-se substâncias químicas, vírus ou agentes físicos, como a luz ultravioleta, tendo como alvo gerar mutações em genes responsáveis pelo controle do ciclo celular.
Células transformadas também podem ser obtidas de tecidos já mutados, como é o caso de tecidos tumorais como as células HeLa (descritas a seguir). Tais células são genética e morfologicamente diferentes do tecido original e em certos casos não possuem dependência de ancoragem e nem possuem inibição por contato (sinais químicos que interrompem a divisão por meio de contatos físicos entre células), além de serem capazes de proliferar infinitamente quando em cultura. Não há um número exato de passagens além do qual não se dê mais para utilizar um tipo de linhagem específica. Em geral, para que as características fenotípicas não sejam perdidas após muitas passagens, é comum nos laboratórios utilizar células até passagens 70 a 80, mas isso pode variar dependendo do tipo celular (o limite de passagens – divisões celulares – além do qual não seja mais possível a viabilidade da linhagem celular é chamado de limite de Hayflick).
Falando em proliferação “infinita”, você pode estar se lembrando de outro grupo de células com características bem especiais, as células-tronco! Mas não as confunda. As células-tronco fazem parte do desenvolvimento “normal” de um organismo multicelular, possuindo a capacidade de se manter indiferenciadas. Já as linhagens celulares imortalizadas, são células que foram isoladas de um organismo, ou seja, não fazem mais parte dele não estando envolvidas nas mesmas funções, sendo mantidas de forma “artificial” na cultura como ferramenta de estudo para pesquisa. Aliás, se você não viu, temos um módulo bem legal sobre células-tronco aqui no site. A tabela abaixo apresenta alguns outros exemplos de linhagens imortalizadas.
Tabela 1 – Outros exemplos de linhagens imortalizadas.
| Linhagem Celular | Tipo Celular, origem e aplicação | Tipo (propriedade) de crescimento |
| HEK-293T | Célula renal embrionária humana. Frequentemente usada em pesquisas de biologia celular, para estudar sinalização e produção de proteínas recombinantes. | Aderente |
| SH-SY5Y | Neuroblastoma humano, clonado da medula óssea. Têm sido usados para estudar a doença de Parkinson, neurogênese e outras características das células cerebrais. | Aderente/Suspensão |
| HaCaT | Células epiteliais humanas originadas da transformação espontânea de queratinócitos adultos cultivados in vitro. Tem sido um ótimo modelo para estudos de queratinização, homeostase epidérmica e suas patologias, apresentando altas capacidades de diferenciação e proliferação. | Aderente |
| S2 | Células Schneider 2. Células derivadas de uma cultura primária de embriões de Drosophila semelhantes a macrófagos. Estas células podem ser cultivadas à temperatura ambiente, tanto como uma monocamada semi-aderente quanto em suspensão, e podem ser cultivadas na ausência de soro. São utilizados na expressão de proteínas heterólogas e produção de proteínas em larga escala. | Aderente/Suspensão |
| 3T3 | Fibroblastos de camundongo. Derivados de uma mutação espontânea em cultura de tecido embrionário de camundongo. Utilizadas em estudos de transfecção de DNA. | Aderente |
| MDCK | Célula epitelial do rim de cão. Células bem polarizadas, com lados apicais e basais distintos, frequentemente usadas no estudo do tráfego de moléculas, adesão célula-célula, toxicidade e outros. | Aderente |
| VERO | Células epiteliais renais. Obtidas de um macaco verde africano (C. aethiops), sendo utilizadas para o desenvolvimento de vacinas virais, aprovadas para uso humano (incluindo uma vacina contra o vírus SARSCoV2) e também como células hospedeiras (vírus e parasitas). | Aderente |
| K562 | Células linfoblásticas isoladas da medula óssea de uma paciente com leucemia mielóide crônica de 53 anos. Primeira linhagem celular de leucemia mielóide humana imortalizada a ser estabelecida. Amplamente usada em pesquisa imunológica. | Suspensão |
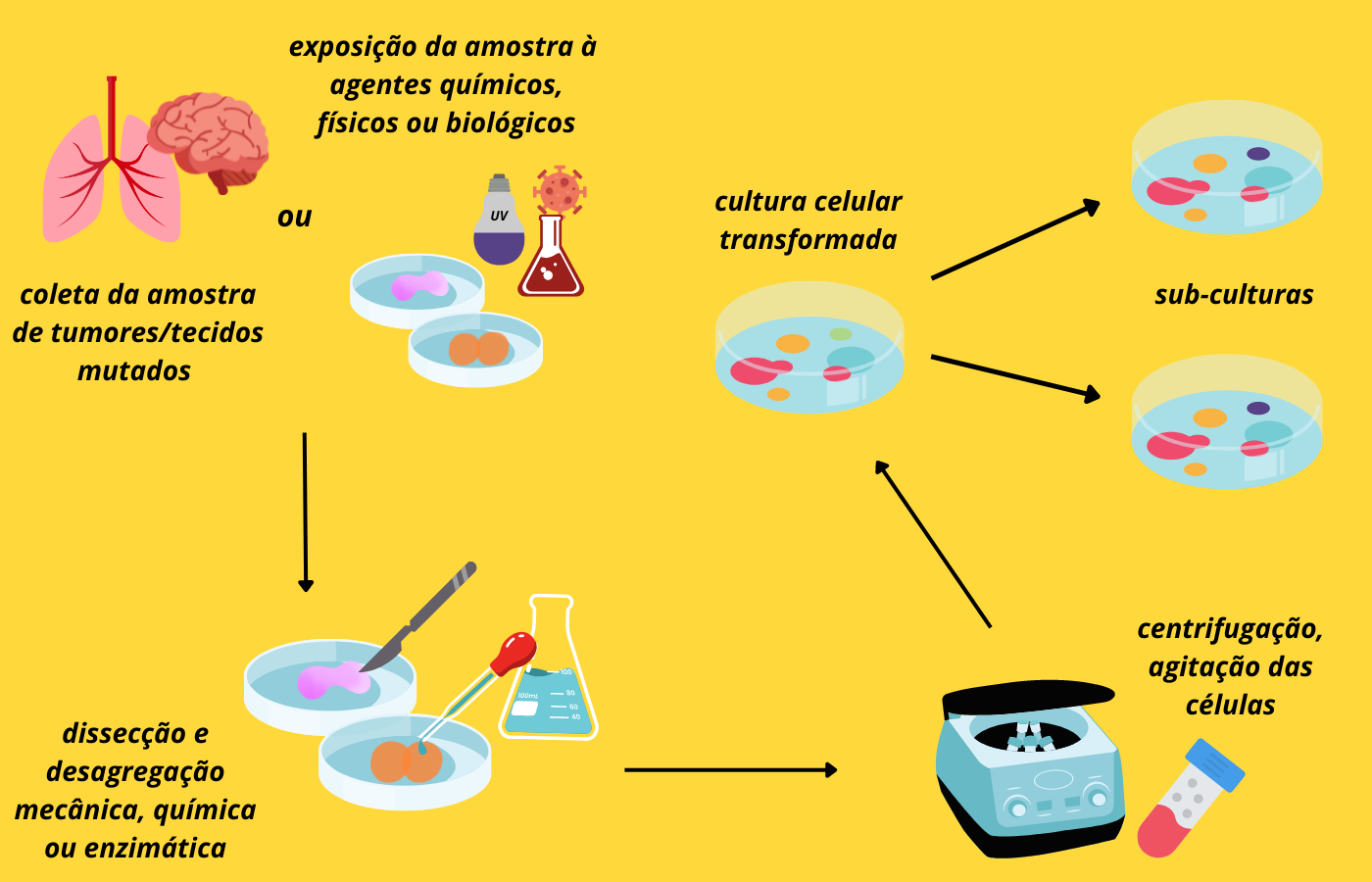
Figura 3 – Cultura transformada e imortalizada. (Crédito: Isaias Cavalcante de Oliveira)
Para saber mais: Células HeLa
A linhagem de células HeLa é considerada a primeira linhagem imortalizada da história. Esse nome corresponde à abreviação de Henrietta Lacks, uma mulher negra, norte-americana, que trouxe uma grande contribuição à ciência e à saúde e que não poderíamos deixar de falar um pouco sobre ela. Na década de 50, Henrietta e seu marido David cuidavam de seus cinco filhos em Baltimore, nos Estados Unidos. Nessa época ficou doente e ainda muito jovem e foi diagnosticada com câncer cervical. Ela teve dificuldades em encontrar um hospital que a tratasse até que deu entrada no Hospital Johns Hopkins, de onde veio seu diagnóstico. Enquanto recebia tratamento, os pesquisadores estavam colhendo amostras do tumor, sem ela saber e autorizar. Uma dessas amostras de tecido tumoral foram enviadas para George Otto Gey, médico e pesquisador de câncer naquele Hospital. Depois de muitos dias de internação e sessões de radioterapia, veio a falecer em outubro de 1951 e ao que indicava a autópsia, o câncer havia se espalhado por todo o corpo.
George estudando as células cancerosas de Henrietta, notou que elas proliferavam muito rapidamente (até mesmo se comparadas a outros tumores) e poderiam ser mantidas vivas – in vitro – por muito tempo para maiores análises. Uma particularidade dessa linhagem (e também dos nossos gametas, células-tronco e as células tumorais) é o funcionamento da enzima telomerase, ativada durante a divisão celular. É normal que a cada ciclo celular os telômeros (pequenas porções de DNA nas extremidades dos cromossomos) gradualmente se encurtem impedindo as células de se dividirem indefinidamente. Entretanto, a telomerase é ativada nas HeLa, reconstruindo os telômeros na divisão celular, o que permite uma multiplicação ilimitada. George mantinha as células aquecidas, permitindo seu crescimento e multiplicação, usando em experimentos e enviando amostras pelo correio para cientistas do mundo todo, sendo aplicadas nas mais variadas pesquisas. À época, o método foi usado para desenvolver a vacina da poliomielite, criada por Jonas Salk e Enders. Inúmeros artigos envolvendo as células HeLa foram (e são até hoje) publicados. Muitos estudos envolvem desde desvendar mecanismos do câncer a efeitos da radiação e substâncias químicas em tecido vivo, mapeamento genético, doenças infectocontagiosas e outros.
Infelizmente, mesmo suas células tendo sido amplamente utilizadas, as coletas das amostras (exceto a biópsia do tecido) foram realizadas sem o consentimento de Henrietta Lacks durante o seu tratamento, e nem sua família tinha conhecimento sobre sua utilização. Lembre-se que na época não haviam leis estabelecidas sobre estas questões. Atualmente, as pesquisas requerem aprovação de um comitê de ética e consentimento do paciente. A sua identidade e história praticamente só foram conhecidas após as pesquisas da escritora Rebecca Skloot no livro “A Vida Imortal de Henrietta Lacks” (2010), que deu origem a um filme (2017). Foi Rebecca que informou à família de Henrietta sobre as pesquisas que utilizavam as células HeLa, sendo que a família não teve nenhum ganho financeiro com a ampla utilização dessas células, apesar de serem patenteadas e comercializadas há anos por grandes empresas de biotecnologia.
Apesar das controvérsias e questões bioéticas envolvidas, conforme a história de Henrietta foi elucidada, foram realizadas várias palestras e conferências onde se deu o devido reconhecimento a ela pela imensa contribuição de suas células para a ciência e medicina, trazendo grande visibilidade para a comunidade afro-americana em diversos lugares como Instituto Johns Hopkins (onde há um edifício com seu nome), Faculdade de Medicina Morehouse (Atlanta), Morgan State University (Baltimore). Além de seu nome ter sido utilizado para nomear várias escolas, um planeta-anão do cinturão de asteroides e uma estátua na Universidade de Bristol (Inglaterra). Recentemente (2021), a OMS ofereceu à família um prêmio póstumo em sua homenagem reconhecendo o seu legado. Isso nos mostra como é importante reconhecer injustiças de modo a superá-las e promover uma ciência mais igualitária e compromissada com toda sociedade.
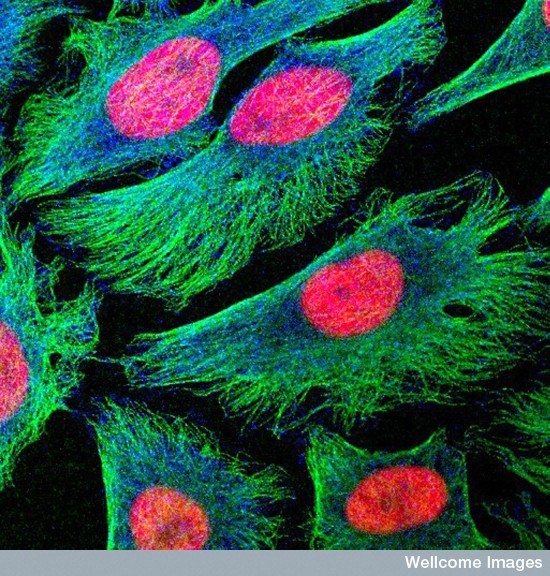
Figura 4 – Células Hela em cultura mostrando os núcleos em vermelho e o componente tubulina do citoesqueleto em verde. A coloração azul é uma proteína de checkpoint mitótico que permanece no citoplasma até a pró-metáfase, quando está envolvida na regulação da divisão celular. A imagem foi obtida em microscopia confocal de fluorescência. Imagem sob licença CC BY-NC-ND- 3.0 | Ref: doi:10.7295/W9CIL38912 | CIL: 38912. Autoria: Matthew Daniels.
Como adquirir?
Como já mencionado, a obtenção de células pode ocorrer a partir do isolamento de células de um tecido/órgão/organismo doador. Entretanto, dado que o conhecimento sobre técnicas de cultivo aumentou muitos ao longo dos anos, assim como a tecnologia, muitas linhagens de células surgiram e com elas bancos de células foram criados em todo o mundo. Atualmente existem muitos sites e conteúdos na internet com informações sobre a aquisição de linhagens e condições para manuseá-las que incluem o meio de cultura ideal, procedência, morfologia, biossegurança, entre outros aspectos, assim como plataformas especializadas em venda de células. A integridade do banco de células e qualidade das linhagens celulares é mantida por um sistema de gestão bem organizado baseado em procedimentos de biossegurança e uma série de testes bioquímicos e moleculares para identificação das linhagens (como a análise de isoenzimas, perfil de STR, DNA barcoding) também visando conservar suas características biológicas. Desse modo, é possível obter células de acordo com o perfil desejado para estudo (tipo celular, morfologia, organismo, modo de crescimento, etc.), inclusive com o número de passagens determinadas. A tabela abaixo resume alguns dos principais sites e bancos de células conhecidos, seja para aquisição de linhagens propriamente ditas ou de insumos e equipamentos para laboratório, instruções de manipulação de culturas e outras informações e serviços.
Tabela 2 – Bancos de células para aquisição de linhagens celulares.
| The European Collection of Authenticated Cell Cultures (ECACC) | https://www.culturecollections.org.uk/ |
| American Type Culture Collection (ATCC) | https://www.atcc.org/ |
| Allen Institute For Cell Science | https://www.allencell.org/ |
| Common Access to Biological Resources and Information | http://www.cabri.org/ |
| Interlab Cell Line Collection (ICLC) | http://www.iclc.it/details/ |
| Japanese Collection of Research Bioresources (JCRB) | https://cellbank.nibiohn.go.jp/ |
| Sigma-Aldrich Corporation/Merck | https://www.sigmaaldrich.com/BR/pt/ |
| Thermo Fisher Scientific | https://www.thermofisher.com/ |
Como manter?
OK, já sabemos como conseguir. Mas o que fazer para manter as células em funcionamento? Como vimos, é interessante que o ambiente onde as células são cultivadas seja o mais parecido com o de origem e ofereçam os nutrientes necessários a seu desenvolvimento. O então chamado de “meio de cultura” inclui açúcares, vitaminas, aminoácidos (essenciais e não essenciais), proteínas, sais, antibióticos, e frequentemente fatores de cultivo, hormônios e um indicador de pH, que variam em função da linhagem celular cultivada. Entre os meios de cultura mais conhecidos está o RPMI-1640 desenvolvido na década de 60 por uma equipe de cientistas no antigo Roswell Park Memorial Institute, de onde vem o nome. O RPMI-1640 geralmente é suplementado com soro de cavalo (horse serum – HS), soro bovino fetal (fetal bovine serum – FBS) ou soro fetal de bezerro (fetal calf serum – FCS), e é utilizado para uma grande variedade de células de mamíferos como HeLa, Jurkat, MCF-7, PC12, PBMC e outras. Muitas vezes o meio de cultura onde há soro é denominado de meio completo pois o soro tem uma composição complexa e é rico em fatores de crescimento que induzem a proliferação e fatores de adesão. Outro meio bastante utilizado é o Dulbecco Eagle’s Medium (D-MEM) e recebe esse nome por se tratar de modificação do Basal Medium Eagle (BME), contendo quatro vezes a concentração de aminoácidos e vitaminas no BME, também tendo suplementação de soro fetal bovino. Aqui só estão alguns exemplos para uma série de meios de culturas que existem. Os principais indicadores da necessidade de reposição do meio de cultura são o pH (em meios que apresentem o vermelho de fenol, por exemplo, há mudança de coloração do meio – ver tabela abaixo), a densidade (número de células, curva de crescimento) e a morfologia celular (tamanho das células, granularidade, formação de vacúolos no citoplasma, etc).
Tabela 3 – Composição geral do meio RPMI-1640. A concentração de cada componente não foi informada porque existem diferentes formulações. A partir dos componentes é possível observar que o meio RPMI 1640 usa um sistema tampão de bicarbonato, permitindo a manutenção do pH fisiológico em uma atmosfera com 5–10% de CO2. Normalmente, o meio não contém proteínas ou fatores de crescimento, por isso é comumente suplementado com 10% de soro fetal bovino.
| Glicose |
| Vermelho de fenol, um indicador de pH |
| Sais (Cloreto de sódio, bicarbonato de sódio, fosfato dissódico, cloreto de potássio, sulfato de magnésio e nitrato de cálcio) |
| Aminoácidos (glutamina, arginina, asparagina, cistina, leucina e isoleucina, cloridrato de lisina, serina, ácido aspártico, ácido glutâmico, hidroxiprolina, prolina, treonina, tirosina e valina, histidina, metionina, fenilalanina, glicina, triptofano e glutationa reduzida) |
| Vitaminas (i-inositol, cloreto de colina, ácido para-aminobenzoico [PABA], ácido fólico, nicotinamida, cloridrato de piridoxina e cloridrato de tiamina; pantotenato de cálcio, biotina, riboflavina, cianocobalamina) |
| Outros (soro fetal bovino) |
A manutenção das células é simples e consiste em trocar periodicamente o meio de cultura (~48 horas, a depender do tipo celular e velocidade de crescimento), garantindo a nutrição adequada e a remoção de produtos residuais do metabolismo. Faz parte do processo observar a velocidade de crescimento das células continuamente ao microscópio, por contagem de células e por meio de testes bioquímicos, analisando os efeitos da adição ou remoção de moléculas específicas, como hormônios ou fatores de crescimento. Caso estejam em confluência é necessário realizar a passagem, lembrando que para células aderidas é necessário promover a ruptura da adesão celular. Geralmente a concentração de células em cultura fica próximo de 1 x 105 a 1 x 106 células/mL, podendo variar de acordo com o tipo celular.
Como preservar? (Criopreservação)
Uma grande vantagem de se trabalhar com células consiste na possibilidade de seu congelamento, armazenando-as para estudos posteriores, diminuindo o risco de contaminação e permitindo que as células diminuam ou mesmo atrasem o surgimento de eventuais alterações que poderiam ocorrer quando em cultura. Isso porque ao longo de muitas passagens e consequentemente de muitas replicações celulares, o DNA fica mais sujeito a sofrer alterações. Essa técnica é denominada de criopreservação. O processo geralmente é lento e consiste em congelar as células em nitrogênio líquido (N2) com diminuição de 1°C por minuto. Dessa forma, a lentidão do processo é importante para permitir um efluxo (saída) suficiente de água das células, por diferenças de pressão osmótica, minimizando a probabilidade de formação de gelo intracelular e consequentemente de rompimento da membrana e morte celular. Também são adicionados os crioprotetores, substâncias que protegem as células de danos de congelamento. O agente crioprotetor mais utilizado é o dimetilsulfóxido (DMSO), e em menor grau o glicerol. Praticamente não há diferenças entre os processos de congelamento e descongelamento para células aderentes ou em suspensão. Um resumo do processo encontra-se na figura abaixo.
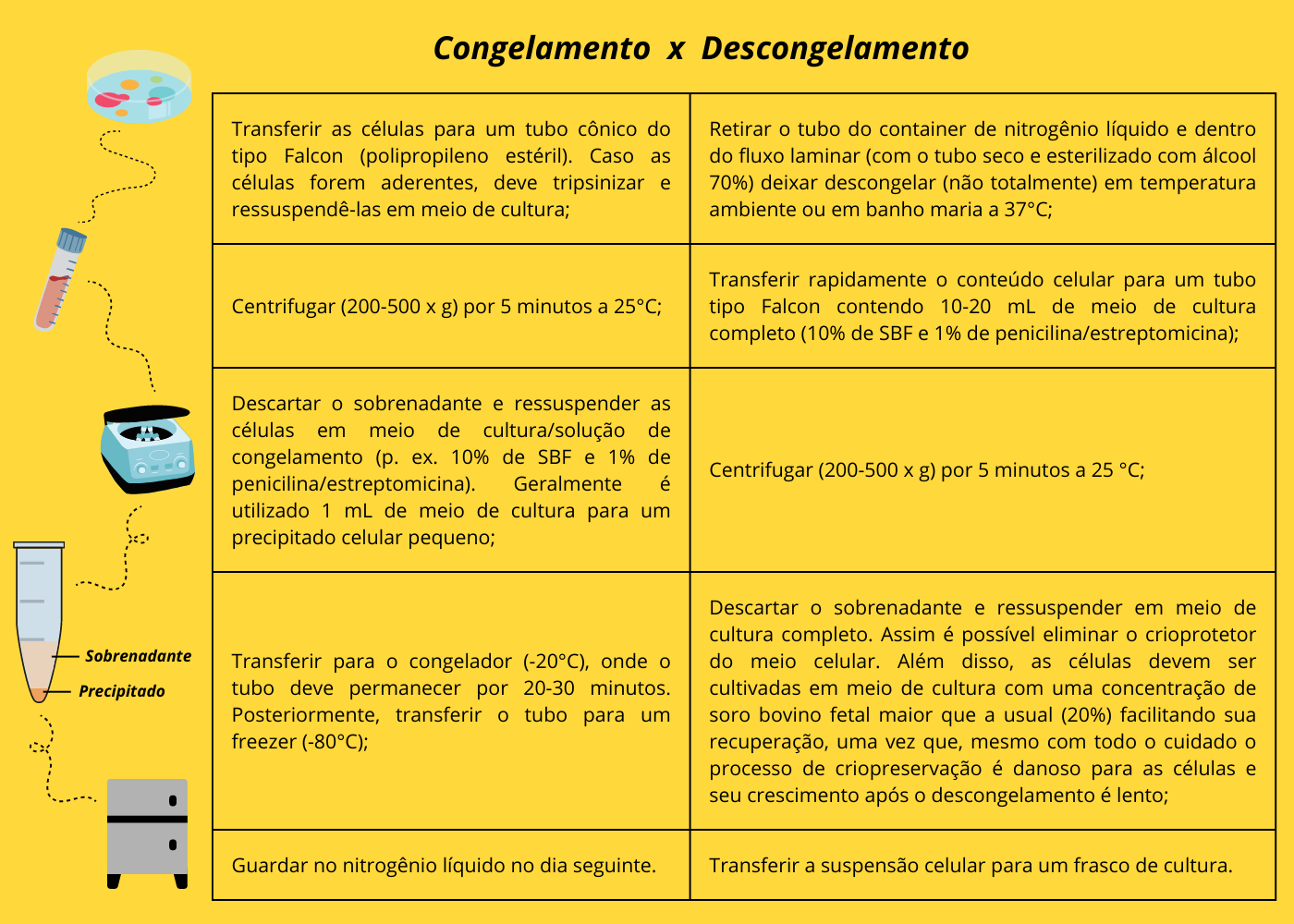
Figura 5 – Etapas da criopreservação (congelamento e descongelamento). Baseado em Peres et al. (2005) e Gonçalves et al. (2020). (Crédito: Isaias Cavalcante de Oliveira)
Como contar?
A contagem de células é um processo muito importante durante a condução de um experimento e em vários procedimentos em biologia e medicina diagnóstica. O método tradicionalmente utilizado é com uma câmara de contagem, também conhecida como câmara de Neubauer, ou ainda hemocitômetro, pois foi desenvolvida originalmente para quantificar a concentração de células sanguíneas. Esse dispositivo é uma lâmina grossa com duas câmaras gradeadas no meio, que são cobertas com uma lamínula de vidro especial durante a contagem. Cada uma dessas câmaras (grids) possui 9 quadrados de 1 mm cada, com linhas (malhas) gravadas dividindo-os em quadrantes de dimensões conhecidas. Uma pequena quantidade da cultura celular (~10 μl) é colocada no espaço entre a câmara e a lamínula de vidro, que é preenchido por capilaridade, sendo esse espaço formado de 0,1mm. Desse modo o volume total de cada quadrado corresponde à 1mm x 1mm x 0,1mm que é igual a 0,1 mm3 ou 0,1μl (microlitros). Assim que a contagem é realizada, deve-se multiplicar o número obtido pelo fator 104.

Figura 6 – Foto da câmara de Neubauer. Imagem em domínio público. Autor: Alcibiades. Fonte.
Para realizar a contagem, a solução contendo as células deve ser homogênea e ter a concentração apropriada, certo? Uma alta concentração de células dificulta a contagem uma vez que elas se sobrepõem, sendo necessário diluir no próprio meio de cultura ou em PBS (solução salina fosfato). Já uma baixa concentração, pode levar a erros estatísticos, além de serem necessários mais quadrantes para contagem, demandando mais tempo. Para as células aderidas recomenda-se preparar uma solução com tripsina e EDTA onde a primeira atua digerindo as proteínas de adesão e o segundo sequestrando íons (Ca2+ e Mg2+). Após isso, uma pequena quantidade da solução é colocada sobre o espaço entre câmara e lamínula e levada ao microscópio onde o pesquisador conta manualmente o número de células.
Para contagem podem ser utilizados os quadrados externos ou o central a depender da concentração e tamanho celular. Caso sejam os externos é necessário realizar uma média para resultados mais exatos. Como cada quadrante tem 3 linhas padronizadas que os dividem, devem ser excluídas da contagem as células sobre as linhas inferior e direita ou superior e esquerda garantindo que as células que dividem dois quadrantes sejam contadas uma única vez. A concentração total é obtida da seguinte forma: (N° total de células contadas * fator de diluição * 104 = N° células/mL) / N° de quadrados contados.
Existem também contadores automáticos.
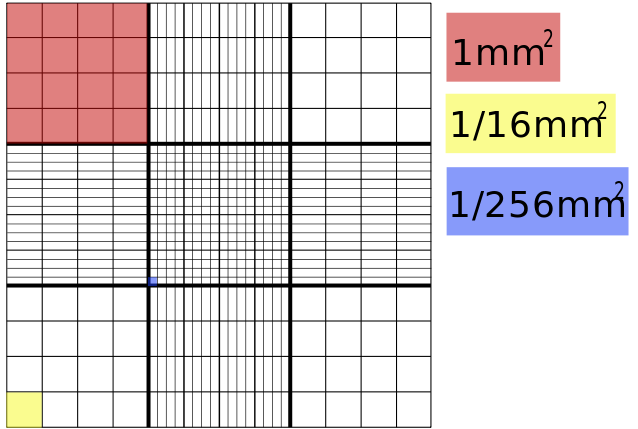
Figura 7 – Esquema da câmara de Neubauer indicando as medidas de cada quadrado. Imagem de uso livre. Fonte.
Outros métodos também são muito usados para avaliar e contar as células durante experimentos específicos, como citometria de fluxo e análise de imagens. O primeiro consiste em um aparelho sofisticado em que as células seguem individualmente em um estreito fluxo na frente de um sistema que emite um feixe de luz sobre elas e detecta a luz refletida. Muitas coisas podem ser analisadas como a forma das células e suas estruturas internas e externas, quantidade de biomoléculas (ex. proteínas), viabilidade celular, imunofenotipagem, etc. O segundo inclui uso de softwares e algoritmos para realizar detecção, análise e contagem automática de células através de imagens de microscopia de boa qualidade.
Coloração de células
Para identificar estruturas, auxiliar na quantificação e verificar a viabilidade celular são usados diferentes métodos de coloração. Um corante bastante usado após a contagem para verificar a viabilidade celular é o azul de Trypan (geralmente na concentração de 1% em PBS). Quando vivas, as células têm sua membrana plasmática íntegra e não incorporam o corante, enquanto as células mortas incorporam o corante e ficam azuis ao serem visualizadas em microscópio.
Cuidados com a cultura
Já pudemos ver um pouco da história, aquisição, metodologias e o quão promissora é essa área de estudo das células. Agora nos resta responder outra pergunta. Que cuidados são necessários quando se cultiva células? Trabalhar em um laboratório com cultivo celular envolve não só o planejamento das atividades a serem realizadas como também o cuidado com exposição a agentes infecciosos abrigados por células cultivadas (por exemplo, os vírus HBV, HIV) e de reagentes químicos que podem ser tóxicos, corrosivos ou mutagênicos. Esses fatores podem colocar em risco a saúde das pessoas que trabalham no laboratório quando introduzidos no corpo (por exemplo, através do contato da pele e mucosas com sólidos, líquidos ou aerossóis, inalação e outros). Ou seja, é necessário conhecer e utilizar práticas, tecnologias e equipamentos que visam prevenir a exposição a agentes patogênicos e químicos, ou a sua liberação acidental (biossegurança).
As contaminações geralmente não podem ser totalmente evitadas. Para tanto, é importante treinar a equipe do laboratório de cultura de células para reconhecer os primeiros sinais, a fim de evitar a propagação de contaminantes para outras células ou produtos de cultura de células. Os contaminantes mais comuns são de natureza biológica, incluindo principalmente bactérias (especialmente Mycoplasma, bactérias muito interessantes que carecem de parede celular), fungos, vírus e até mesmo outras linhagens celulares (contaminação cruzada). Portanto, é recomendável que a equipe do laboratório realize o trabalho em uma cabine de segurança biológica (câmara de fluxo de ar laminar estéril). Usar equipamentos de proteção individual como avental, máscara, luva cirúrgica e calçados fechados. Sempre esterilizar os instrumentos antes e após o uso, assim como descontaminar materiais destinados ao descarte. Antes e após o manuseio das células deve-se lavar as mãos e antebraço com água e sabão e quando necessário usar álcool 70%. Preferencialmente, não se deve usar anéis, pulseiras, relógios ou outros acessórios durante as manipulações. Por fim, é importante manter as vacinas em dia.
Exemplos e aplicações
As famosas células-tronco: Um exemplo a partir de células hemocitopoéticas e mesenquimais
Pode-se dizer que todos os tipos de células sanguíneas diferenciadas tem origem em uma célula-tronco precursora, considerada por muitos autores como multipotente, a célula-tronco hemocitopoética (hemocitoblasto). Como todas células tronco, as células-tronco hemocitopoéticas (CTH) possuem a capacidade de autorrenovação e diferenciação em células especializadas, sendo neste caso em hemácias e células do sistema imune (como os leucócitos, monócitos, neutrófilos, etc). Por essa capacidade elas têm chamado a atenção dos pesquisadores que utilizam esse potencial no tratamento de diversas patologias como leucemia e anemia, problemas de coagulação sanguínea, neuroblastoma, talassemia maior, imunodeficiências e outros.
Nos seres humanos, o principal local onde ocorre a produção de células sanguíneas é a medula óssea, enquanto que em ratos e camundongos ocorre tanto no baço quanto na medula óssea. Em humanos sua obtenção pode ser feita a partir da medula óssea, do cordão umbilical ou do sangue periférico. Em ratos e camundongos geralmente são obtidas da medula óssea do fêmur e tíbia e, menos frequentemente, do baço. Na obtenção de células a partir da medula óssea geralmente é realizada uma lavagem da cavidade óssea seguida da dispersão mecânica do tecido. Existem outros tipos de células tronco também muito utilizadas pelos cientistas, como as células mesenquimais (CTM). O processo de obtenção dessas células é semelhante ao das CTH. As células tronco mesenquimais encontram-se imersas no estroma medular mas também podem ser obtidas de tecido adiposo, músculo esquelético, polpa dentária, membrana sinovial, cordão umbilical e também do sangue periférico.
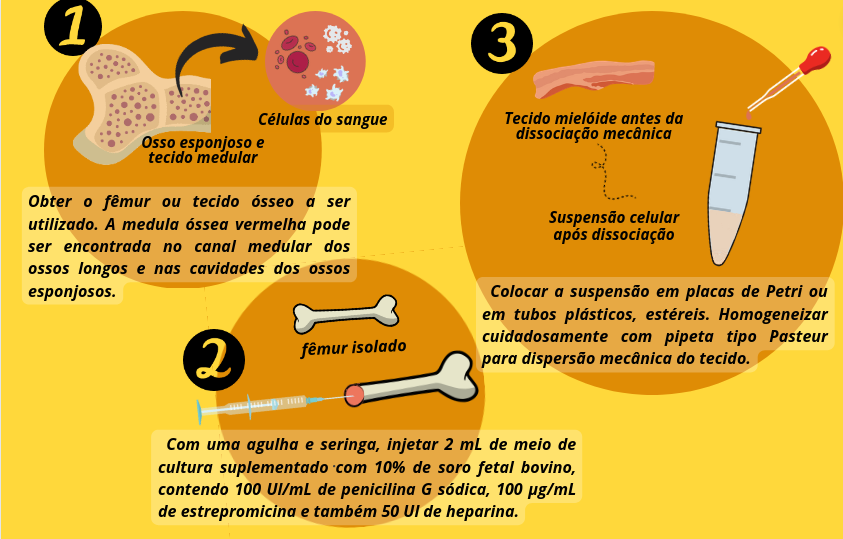
Figura 8 – Obtenção de células-tronco em ratos e camundongos a partir da medula óssea, para cultura primária. Baseado em Peres et al. (2005). (Crédito: Isaias Cavalcante de Oliveira)
Borboletas, mariposas, mosquitos… É possível cultivar células de insetos?
Os primeiros estudos com células de insetos em cultura aconteceram no século passado, sendo as primeiras linhagens imortalizadas estabelecidas por Thomas D.C. Grace na década de 60, originadas do tecido ovariano da mariposa imperadora Antheraea eucalypti (atualmente incluída no gênero Opodiphthera). O meio de cultura utilizado nesses estudos, o meio de inseto Grace (Grace’s medium), passou por algumas modificações e ainda é utilizado atualmente para o cultivo de muitas das linhagens celulares de insetos que foram desenvolvidas desde então (existem mais de 500 linhagens!). Os meios podem ser suplementados com a hemolinfa do próprio inseto ou do bicho-da-seda (Bombyx mori) e até mesmo soro de vertebrados. Tais células são consideradas de fácil cultivo e mais resistentes que a de mamíferos.
A grande maioria das linhagens celulares de insetos, especialmente de lepidópteros (borboletas e mariposas), é utilizada para expressar peptídeos, enzimas e proteínas recombinantes (como a miosina dos nossos músculos), geralmente por expressão transitória. Essas células também são utilizadas em estudos sobre a própria biologia desses insetos, na patogênese viral e para propagação desses vírus em grandes volumes. Um exemplo desse tipo de célula é a linhagem Sf21, isolada por Vaughn e colaboradores (1977), oriunda da lagarta-do-cartucho (Spodoptera frugiperda), cujas culturas primárias foram preparadas a partir de ovários imaturos de indivíduos na fase de pupa. A lagarta-do-cartucho é considerada uma das principais pragas da cultura do milho (também do trigo, algodão, mandioca) e sendo um inseto polífago, apresenta enorme potencial de danos agrícolas. Dado este contexto, essa linhagem vem sendo utilizada para a produção de biopesticidas, podendo ser cultivadas em suspensão com altas taxas de crescimento. O processo consiste em infectar as células da lagarta com baculovírus modificados, vírus que infectam artrópodes sem se replicar em vertebrados (incluindo nós seres humanos) e em plantas, que destroem essas células, sendo ótimos agentes de biocontrole de pragas agrícolas e produzindo grande número de partículas virais.
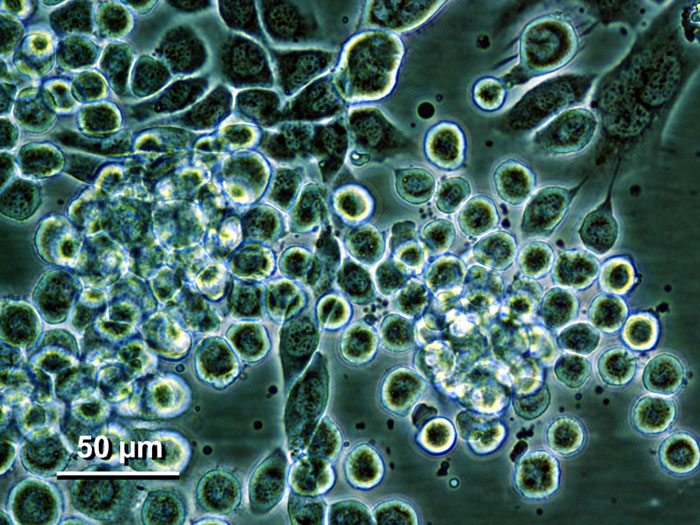
Figura 9 – Células Sf21. Apresentam um formato esférico, tamanhos desiguais e aparência levemente granular. É considerada uma cultura semi-aderente. Imagem em domínio público. Autoria: Dwight Lynn. Fonte.
Outras linhagens muito utilizadas são a S2 da mosca-da-fruta (Drosophila melanogaster), Tn-368 derivada de tecidos ovarianos e BTI-Tn-5B1-4 de embriões da lagarta mede-palmo (Trichoplusia ni), além de linhagens de insetos que nos são mais familiares como o mosquito da dengue (Aedes aegypti), abelha-europeia (Apis mellifera) e bicho-da-seda (Bombyx mori).
SARS-CoV-2: da pesquisa à sociedade
Muitos aspectos da COVID-19 foram desvendados a partir de procedimentos de cultivo celular, tanto com uso de células de indivíduos infectados como também de diferentes tipos de linhagens celulares. A infecção é causada pelo SARS-CoV-2 (da família dos coronavírus), um vírus com RNA de fita simples (positiva), e que embora tenha como alvo as vias respiratórias e os pulmões muitos estudos já mostraram que o coronavírus pode afetar outras regiões do corpo humano como coração, rins e sistema nervoso central. O vírus usa como receptor de entrada na célula a enzima conversora de angiotensina tipo 2 (ECA-2), uma molécula muito presente na superfície das células do endotélio, dos rins, dos pulmões e de outros órgãos.
Em biópsias e estudos histológicos com pacientes infectados (pós morte), muitos pesquisadores já demonstraram que o vírus causa uma série de lesões e alterações celulares e teciduais como destruição das células alveolares, ativação exagerada de linfócitos e fatores pró-inflamatórios, formação de sincícios (células gigantes multinucleadas) e tamanho celular aumentado, alterações na coagulação sanguínea, e outros. Utilizando células Vero E6 e HEK293T já comentadas aqui (tabela 1), pesquisadores puderam descrever como a proteína humana conhecida como PCNA (Proliferating Cell Nuclear Antigen) interage com a proteína M (matriz) do SARS-CoV-2, uma das moléculas que compõem a membrana do vírus e dão forma a ele. Outros estudos avaliam o uso de células-tronco na terapia celular objetivando a regulação imune e melhora no reparo de dano tecidual, interação do vírus com cardiomiócitos (células do coração), infecção de células do sistema nervoso em células de hamsters (como os astrócitos) e como o vírus utiliza glutamina (um aminoácido precursor do neurotransmissor glutamato) para produzir energia e se replicar, além do fenômeno da tempestade de citocinas por macrófagos, produção de vacinas, e outros.
Figura 10 – Representação esquemática do SARS-CoV-2. Imagem royalty-free. Autoria: Daniel Dan (outsideclick). Fonte.
Muitos desses estudos são realizados por pesquisadores da USP e seus institutos como o Instituto de Ciências Biomédicas (ICB), Instituto de Biociências (IB), Faculdade de Medicina (FM), Faculdade de Medicina (FMRP) em colaboração com pesquisadores de diferentes universidades do Brasil e do mundo inteiro.
Cultura celular de plantas
Para a botânica, pequenos fragmentos de tecido vivo, os explantes, podem ser isolados de um organismo vegetal, como fragmentos de folha, de raiz, de caule ou de qualquer tecido da planta, esterilizados (eliminação de microrganismos) e cultivados assepticamente, por períodos indefinidos em um meio de cultura apropriado. Muitas células vegetais apresentam totipotência, especialmente os meristemas, chamadas por alguns de “células-tronco vegetais”, dependendo dos estímulos recebidos, condições específicas de cultivo e do momento do ciclo de vida, podendo gerar um novo indivíduo multicelular. Tais culturas têm grandes aplicações em biotecnologia, pesquisas genéticas e moleculares, melhoramento vegetal, produção agrícola e de fármacos e conservação ambiental.
A propósito, o que comentamos aqui sobre os meristemas é alvo de discussões e queria compartilhar com você um pouco mais. O desenvolvimento animal e vegetal apresentam processos bem diferentes, e a participação das células-tronco nesses processos tem características específicas para cada grupo. A maioria das células animais, logo no começo do desenvolvimento embrionário, acaba perdendo a totipotencialidade e tornando-se cada vez mais diferenciadas, resultando em células pluripotentes (como as do embrioblasto), multipotentes (como as sanguíneas) e unipotentes (como as espermatogônias). Desse modo, em animais, parte dessas células-tronco (mantidas indiferenciadas) podem repor as células células diferenciadas que acabaram morrendo, garantindo a sobrevivência dos organismos (há exceções, é claro). Já nas plantas, as células-tronco são constantemente produzidas e utilizadas como fonte contínua de células envolvidas na formação e modulação de novas estruturas (ex. folhas, caule, raiz, flores) durante toda a vida da planta. Desse modo, os meristemas constituem o ambiente gerador e mantenedor das células-tronco nas plantas.
Tudo isso e um pouco mais
Ufa! Se você chegou até aqui, já pôde ver que é impossível esgotar todos os exemplos, aplicações e procedimentos em um único módulo. Muitas linhagens celulares foram e vêm sendo estabelecidas ao longo dos anos. Além dos exemplos citados, outras linhagens incluem de cnidários (águas-vivas), moluscos, crustáceos, répteis, anfíbios, aves, peixes, nemátodes e também de grupos de mamíferos, além dos humanos e roedores, como os marsupiais, cetáceos, felídeos, canídeos, suínos, primatas não-humanos, entre outros. Muitos desses estudos visam compreender a biologia desses organismos, a conservação e multiplicação de espécies ameaçadas ou em risco de extinção, a produção de linhagens pluripotentes induzidas, avaliação de fármacos e toxinas bem como a produção de soros, e conhecimento sobre patologias como o câncer.
Um último ponto muito interessante é a possibilidade de gerar produtos alimentícios a base de células! Já pensou como será a comida do futuro? A produção de alimentos baseada em células já é realidade e faz uso do cultivo in vitro de células animais e também microbianas na produção de análogos de proteínas animais específicas, como as do leite ou do ovo. Já existem hambúrguer de carne bovina à base de células cultivadas, nuggets de frango (inclusive já comercializado na Singapura), filé de peixe e avanços nas pesquisas visando o desenvolvimento de produtos similares aos de origem animal, como carnes, aves, frutos do mar, laticínios e ovos, em muitos países.
Para uso offline:
Para uso em seus estudos quando não é possível conexão com a internet.
Cellzine – Cultura Celular (Versão resumida em PDF para impressão em uma folha A4)
Referências:
- AGATHOS S. N. Development of serum-free media for lepidopteran insect cell lines. Methods in molecular biology (Clifton, N.J.), 388, 155–186, 2007. https://doi.org/10.1007/978-1-59745-457-5_8
- ALBERTS, B. et al. 2017. Biologia Molecular da Célula. 6ª ed. Artmed
- ALVES, EMANUELE A.; GUIMARÃES, ANNA C. ROSA. Cultivo celular. Em: MOLINARO et al. (Org.). Conceitos e métodos para a formação de profissionais em laboratórios de saúde. v.2. Rio de Janeiro: EPSJV, 2010. p. 215-253, Cap. 5. https://www.arca.fiocruz.br/handle/icict/13410
- ANDRADE, S. R. MONTEIRO. Princípios da cultura de tecidos vegetais. Documentos – Embrapa Cerrados, ISSN 1517-5111; 58. Planaltina: Embrapa Cerrados, 2002. https://ainfo.cnptia.embrapa.br/digital/bitstream/CPAC-2009/24719/1/doc_58.pdf
- BRITANNICA, T. EDITORS OF ENCYCLOPAEDIA. Ross Granville Harrison. Enciclopédia Britânica, 2023 . https://www.britannica.com/biography/Ross-Granville-Harrison
- CASTRO, ÉRIKA B. DE LIMA. Biotecnologia na Agronomia: Cultura de tecidos vegetais. https://petagronomia.ufc.br/pt/tecnopet/biotecnologia-na-agronomia-cultura-de-tecidos-vegetais/
- CAVALCANTE, P. E. DA SILVA. Utilização de células de inseto, linhagem Sf21, na produção in vitro de bioinseticidas virais para o controle de pragas agrícolas. Monografia, UFPB/Biotecnologia. João Pessoa, 2018. http://www.cbiotec.ufpb.br/ccbiotec/contents/tccs/2018.1/tcc_versao_final_corrigida.pdf
- CELLOSAURUS. https://www.cellosaurus.org/index.html
- CHARELLI, L. Filé de peixe feito em laboratório já é uma realidade. BioEdTech. https://www.bioedtech.com.br/post/fil%C3%A9-de-peixe-feito-em-laborat%C3%B3rio-j%C3%A1-%C3%A9-uma-realidade
- CINATL, J. et al. Suspension culture of HeLa cells in protein-free medium: sensitivity to human pathogenic viruses, Intervirology, v. 37, n. 6, p. 361–366, 1994. https://pubmed.ncbi.nlm.nih.gov/8586536/
- FAO. Food safety aspects of cell-based food. Background document three – Regulatory frameworks. Rome, 2022. https://doi.org/10.4060/cc2353en
- FEEVALE. Cultivo de células: uma alternativa para o uso de animais em pesquisas. Disponível em: https://feev.as/89dc341
- GONÇALVES, JUAN C. RAMOS; SOBRAL, MARIANNA V. (Org.). Cultivo de células: da teoria à bancada. João Pessoa: Editora UFPB, 2020. Disponível em: http://www.editora.ufpb.br/sistema/press5/index.php/UFPB/catalog/download/669/839/7054-1?inline=1
- GRACE, T. Establishment of Four Strains of Cells from Insect Tissues Grown in vitro. Nature 195, 788–789, 1962. https://doi.org/10.1038/195788a0
- ICB-USP (Instituto de Ciências Biomédicas). Pesquisadores descobrem que coronavírus infecta células do coração e vão usá-las para testar medicamentos. Aline Tavares, Acadêmica Agência de Comunicação, 2020. ww3.icb.usp.br/pesquisadores-descobrem-que-coronavirus-infecta-celulas-do-coracao
- JORNAL DA USP. Coronavírus infecta células do sistema nervoso e depende de aminoácido para se replicar. Fabiana Mariz, 2020. https://jornal.usp.br/ciencias/coronavirus-infecta-celulas-do-sistema-nervoso-e-depende-de-aminoacido-para-se-replicar
- __ Sars-cov-2 inibe remoção de células mortas pelo sistema imune, favorecendo o dano pulmonar. Karina Toledo, Agência Fapesp, 2021. https://jornal.usp.br/ciencias/sars-cov-2-inibe-remocao-de-celulas-mortas-pelo-sistema-imune-favorecendo-o-dano-pulmonar/
- JORNAL DA UNICAMP. Pesquisadores descobrem potencial mecanismo de ação da Covid-19 no pulmão humano. Edimilson Montalti, Assessoria de Imprensa FCM, 2020. https://www.unicamp.br/unicamp/ju/noticias/2020/11/24/pesquisadores-descobrem-potencial-mecanismo-de-acao-da-covid-19-no-pulmao
- LIU, C., HAO, J., YAO, L. L., WEI, M., CHEN, W., YANG, Q., & LI, X. D. Insect Sf9 cells are suitable for functional expression of insect, but not vertebrate, striated muscle myosin. Biochemical and biophysical research communications, 259–266, 2022. https://doi.org/10.1016/j.bbrc.2022.10.055
- LYNN D. E. Methods for maintaining insect cell cultures. Journal of insect science (Online), 2, 9, (2002). https://doi.org/10.1093/jis/2.1.9
- ONU NEWS. OMS reconhece legado de Henrietta Lacks à ciência e à saúde. Outubro/2021. Disponível em: https://news.un.org/pt/story/2021/10/1766482
- PERES, C. M.; CURI, R.; PAFFARO, A. M. D. A.; MARTINS, A. K. A.; PIMENTA, A.; GONÇALVES, C. R; MARTINS, E. F. Como cultivar células, Rio de Janeiro: Guanabara-Koogan, 2005.
- REIS, Maria D. dos Santos. Lesões celulares e teciduais provocadas pelo novo coronavírus. 2020. https://icbs.ufal.br/pt-br/institucional/covid-19/artigos/lesoes-celulares-e-teciduais-provocadas-pelo-novo-coronavirus
- REVISTA FAPESP. Os danos do coronavírus. Ricardo Zorzetto, 2020. https://revistapesquisa.fapesp.br/os-danos-do-coronavirus
- __ Terapias celulares podem reduzir em 60% o risco de morte por COVID-19, aponta estudo. Maria Fernanda Ziegler, Agência FAPESP, 2023. https://agencia.fapesp.br/terapias-celulares-podem-reduzir-em-60-o-risco-de-morte-por-covid-19-aponta-estudo/42152
- RODRIGUES, M. A.; KERBAUY, G. B.. Meristemas: fontes de juventude e plasticidade no desenvolvimento vegetal. Hoehnea, v. 36, n. 4, p. 525–550, 2009. https://www.scielo.br/j/hoehnea/a/ggS6wFBpkHLyJ9FNPJZz6Sd/?lang=pt#ModalHowcite
- SCIENCEDIRECT. Immortalized Cell Line. Disponível em: https://www.sciencedirect.com/topics/neuroscience/immortalised-cell-line#:~:text=Immortalized%20cell%20lines%20are%20either,be%20cultured%20over%20several%20generations.
- SEGERITZ, C. P., & VALLIER, L. Cell Culture: Growing Cells as Model Systems In Vitro. Basic Science Methods for Clinical Researchers. 2017, 151–172. https://doi.org/10.1016/B978-0-12-803077-6.00009-6
- SIGMA ALDRICH. https://www.sigmaaldrich.com/
- TAYLOR, MW. Uma História da Cultura de Células. In: Vírus e Homem: Uma História de Interações. Springer, Cham, 2014. Disponível em: https://doi.org/10.1007/978-3-319-07758-1_3
- THERMO FISHER. https://www.thermofisher.com/
- UYSAL O. et al. Cell and tissue culture: The base of biotechnology. Omics Technologies and Bio-engineering: Towards Improving Quality of Life, 2018, pp. 391-429. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/B9780128046593000178
- VAUGHN, J. L., GOODWIN, R. H., TOMPKINS, G. J., & MCCAWLEY, P.. The establishment of two cell lines from the insect Spodoptera frugiperda (Lepidoptera; Noctuidae). In vitro, 13(4), 213–217, (1977). https://doi.org/10.1007/BF02615077
- WIKIPEDIA: Henrietta Lacks. https://pt.wikipedia.org/wiki/Henrietta_Lacks
- WIKIPEDIA: RPMI 1640. https://en.wikipedia.org/wiki/RPMI_1640
- ZAMBALDE, ÉRIKA P. et al. Characterization of the Interaction Between SARS-CoV-2 Membrane Protein (M) and Proliferating Cell Nuclear Antigen (PCNA) as a Potential Therapeutic Target. Frontiers in cellular and infection microbiology vol. 12 849017. 23 May. 2022, https://www.frontiersin.org/articles/10.3389/fcimb.2022.849017/full
