Arthur Tributino Menezes
Contração Muscular
No nosso corpo os músculos desempenham as mais variadas funções, como a movimentação de membros para caminhar e abraçar; a movimentação da mandíbula para mastigar alimentos; a mudança de expressão facial; os movimentos pulmonares durante a respiração, entre outros.
Os músculos ainda contribuem com a manutenção da homeostase térmica, a partir da produção de calor por tremor (calafrios); com a movimentação do alimento ao longo do tubo digestivo; com a dilatação da pupila nos olhos; com o bombeamento do sangue pelo corpo (nesse caso, o músculo cardíaco).
Tipos de tecidos musculares
Possuímos três tipos de tecidos musculares: o tecido muscular esquelético, o cardíaco e o liso (Figura 1). O tecido muscular esquelético, como o próprio nome sugere, está associado com os ossos do corpo (por exemplo, o bíceps que promove a movimentação do antebraço em relação ao braço). A contração dessa musculatura é voluntária, suas células são cilíndricas, multinucleadas e apresentam um aspecto estriado ao microscópio.

Figura 1 – Tipos de tecidos musculares.
O músculo cardíaco é de contração involuntária. Este também apresenta um aspecto estriado ao microscópio, porém normalmente apresenta células uni ou binucleadas. Outra característica desse tecido é a presença de discos intercalares, que são estruturas relacionadas com a otimização da transmissão do impulso elétrico ao longo do tecido para uma contração adequada à função desse órgão. A musculatura lisa é encontrada principalmente ao longo do trato gastrintestinal. É de contração involuntária, não apresenta um aspecto estriado e suas células são mononucleadas.
A fisiologia da contração muscular é bastante interessante e, uma vez que esse tecido está envolvido em tantas funções, podemos imaginar que alterações no funcionamento normal deste podem levar a alguns problemas, desde efeitos menos graves como uma cãibra até doenças como a distrofia muscular de Duchenne. Seguiremos com o estudo da musculatura estriada esquelética e seu mecanismo de contração e, em seguida, falaremos um pouco sobre a musculatura lisa e a cardíaca.
Estrutura e organização do tecido muscular esquelético
Antes de falarmos sobre a contração muscular em si, precisamos inicialmente conhecer a organização desse tecido, para então entendermos melhor os mecanismos moleculares envolvidos.
Chamamos de unidade motora o conjunto composto por um motoneurônio e as fibras musculares inervadas por este (Figura 2). O motoneurônio é responsável por liberar neurotransmissores na região de contato entre este e a fibra muscular (placa motora) para assim dar início a uma série de eventos que culminarão na contração das fibras musculares.
Figura 2 – Unidade motora. (Créditos: Bruna Afetian Sollitto – modificada de: http://images.slideplayer.com.br/8/2361808/slides/slide_4.jpg)
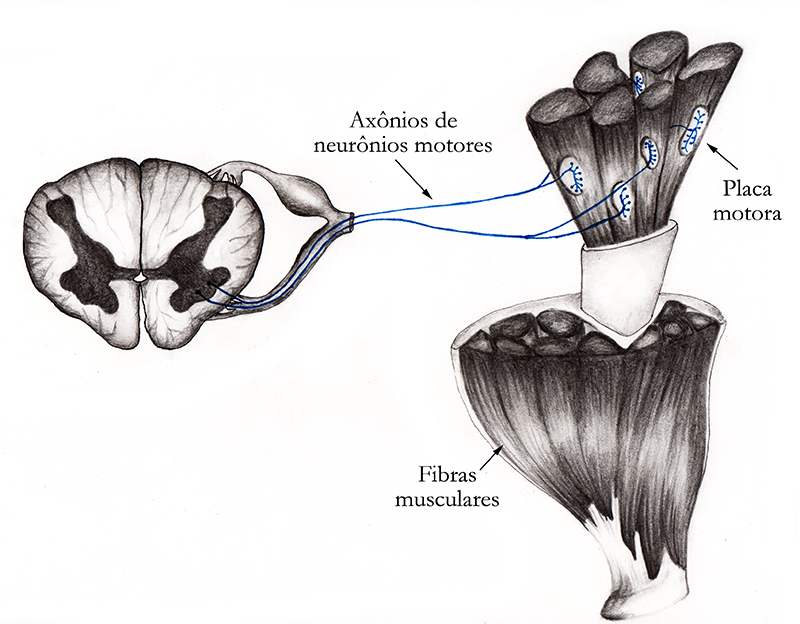
O tecido muscular esquelético possui diversos níveis de organização, começando pelo próprio músculo, passando para os feixes de fibras, fibras musculares (células) e então para as miofibrilas. No interior destas últimas estão os filamentos de actina e miosina, que são as proteínas contráteis responsáveis pela contração muscular (Figura 3).

Figura 3 – Organização estrutural do músculo esquelético.
Além de conhecermos a organização das fibras musculares, precisamos também conhecer algumas estruturas particulares das células do músculo que participam da fisiologia da contração muscular. Uma dessas estruturas é o retículo sarcoplasmático, que consiste em uma especialização do retículo endoplasmático liso que envolve as miofibrilas e têm como principal função o armazenamento de íons Ca2+. Os túbulos T são outras estruturas importantes, que consistem em invaginações do sarcolema (membrana plasmática das fibras musculares) e estão localizadas muito próximas ao retículo sarcoplasmático. Os túbulos T também são conhecidos como canais transversos, e possuem canais de Ca2+ dependentes de voltagem (figura 4).
Figura 4 – Estrutura mais detalhada de uma fibra ou célula muscular esquelética.

As miofibrilas contêm os filamentos grossos (miosina) e os filamentos finos (actina, tropomiosina e troponina). Estas fibras interagem entre si para promover a contração muscular (veremos mais detalhadamente como isso ocorre adiante). Na figura 4, as denominadas “linhas Z” delimitam os sarcômeros (unidades morfofuncionais do músculo esquelético), que se repetem ao longo de toda a miofibrila. É essa organização em sarcômeros que confere o aspecto estriado a esse tecido quando o enxergamos através do microscópio.
Fisiologia da contração muscular
O primeiro evento envolvido com a contração muscular é a liberação de grandes quantidades de acetilcolina (um neurotransmissor) pelo motoneurônio na região de contato entre o neurônio e a fibra muscular. A acetilcolina então se liga em receptores na membrana da fibra muscular, o que promove a abertura de canais iônicos nesta levando a uma despolarização que irá gerar um potencial de ação que viaja ao longo da fibra muscular. Esse potencial de ação chega aos túbulos T, os quais possuem em seu interior canais de Ca2+ dependentes de voltagem do tipo L (de longa duração), que se abrem permitindo o influxo de íons Ca2+. No retículo sarcoplasmático há também canais de Ca2+ que são sensíveis à abertura dos canais de Ca2+ do tipo L. Assim, os canais de Ca2+ do retículo sarcoplasmático se abrem e liberam íons cálcio provenientes do interior do retículo para o citoplasma da célula. Em seguida, esses íons atingem as fibras contratéis presentes nas miofibrilas. A contração muscular se dá através da mudança do tamanho dos sarcômeros (Figura 5).

Figura 5 – Mudança do tamanho dos sarcômeros durante a contração do músculo esquelético.
Agora vamos olhar com mais detalhes como ocorre o encurtamento dos sarcômeros. Como vimos, os filamentos finos são compostos por actina, tropomiosina e troponina, enquanto os filamentos grossos são compostos por miosina (figura 6-a). Os íons Ca2+ liberados do retículo sarcoplasmático se ligam a troponina, o que promove o deslocamento da tropomiosina associada a esta expondo os sítios de ligação da miosina presentes na actina (figura 6-b). Uma vez que isso ocorre, as cabeças de miosina se ligam aos sítios ativos na actina e puxam esse filamento promovendo o encurtamento dos sarcômeros (figura 6-c). Depois, uma molécula de ATP se liga a cabeça de miosina promovendo o desligamento desta da actina, o que permitirá o relaxamento do músculo (figura 6-d). Essa molécula de ATP é clivada a ADP+Pi e as cabeças de miosina retomam a sua posição inicial. Além disso, os íons Ca2+ são novamente bombeados para o interior do retículo sarcoplasmático, de modo que os sítios de ligação das cabeças de miosina presentes na actina são novamente bloqueados pela tropomiosina, impedindo a interação entre as fibras.
Figura 6 – Ciclo de contração e relaxamento da musculatura esquelética através da interação entre os filamentos de actina e miosina.

No estado conhecido como rigor mortis (ou contratura pós-morte), ocorre uma perda do fornecimento de ATP que seria necessário para o relaxamento muscular. Assim a musculatura permanece contraída por até 25 horas após a morte, sendo que o relaxamento só ocorrerá com a degradação das proteínas musculares. Em temperaturas mais elevadas essa degradação pode ocorrer mais cedo e o estado de rigor mortis então irá durar menos tempo.
Há algumas doenças que afetam o funcionamento normal do mecanismo de contração da musculatura esquelética que vimos agora pouco. Uma delas é a miastenia grave. Nessa doença, a comunicação entre o motoneurônio e as fibras musculares inervadas por esse está prejudicada. Em alguns casos isso se deve ao fato de que o indivíduo portador dessa doença começa a produzir anticorpos contra os receptores de acetilcolina, o que causa uma diminuição desses receptores na superfície da membrana celular ou um mau funcionamento dos mesmos. Alguns sintomas provocados por essa doença são fadiga, fraqueza muscular, falta de ar, entre outros. Dentre as medidas comuns para o tratamento, há o uso de drogas que inibam a ação de acetilcolinesterases (enzimas que degradariam a acetilcolina) e a plasmaferese, um procedimento que visa remover do plasma sanguíneo os anticorpos contra os receptores de acetilcolina.
Outra doença bastante conhecida é a distrofia muscular de Duchenne. Os pacientes portadores dessa doença produzem pouco ou não produzem a proteína distrofina, a qual está relacionada com o ancoramento dos filamentos de actina às proteínas integrais da membrana plasmática das células musculares. Caracteristicamente, os pacientes sofrem atrofia dos músculos que vai progredindo com o passar da idade levando à morte, em muitos casos, devido à insuficiência respiratória. Essa doença tem um caráter genético, possuindo um padrão de herança recessiva ligada ao cromossomo X. Assim, ela só afeta homens, uma vez que esses só possuem um único cromossomo X, bastando que para isso eles sejam filhos de uma mãe portadora e recebam tal cromossomo carregando o alelo mutante. Dificilmente uma mulher seria afetada por essa doença, pois para isso ela deveria ser filha de um pai portador da doença, algo que seria muito incomum.
Cãibras
Boa parte das pessoas já teve ou pelo menos já ouviu falar sobre cãibra. Trata-se de uma dor muscular súbita que dá a sensação de que o músculo “deu um nó”, e que normalmente desaparece também rapidamente. Há muito tempo os pesquisadores têm estudado a origem das cãibras, e houve uma época em que se achava que a perda de água e eletrólitos pelo suor era a principal causa destas. Assim, uma das formas dos atletas evitarem as cãibras era ingerir suco de pickles durante os treinos, mas isso não resolvia o problema. Com o tempo, novas observações permitiram avanços nos estudos sobre esse mau funcionamento do músculo. Pesquisadores observaram que, se a perda de água e eletrólitos era o que causava cãibra, porque ela ocorria com mais frequência em alguns músculos do que em outros? Afinal, se assim fosse, esperava-se que as cãibras afetassem praticamente o corpo todo, pois a falta de água e eletrólitos deveria afetar todos os músculos. Além disso, observou-se também que as cãibras eram mais comuns em músculos que estavam sobre trabalho intenso, como os músculos das pernas durante uma corrida.
Atualmente ainda não se sabe ao certo qual o mecanismo molecular das cãibras, e muitas pesquisas estão sendo desenvolvidas com o objetivo de elucidar tal mecanismo. Através de estudos descobriu-se que alguns tipos de cãibras estão relacionados a fatores que podem de alguma forma causar anormalidades metabólicas nos músculos, como frio intenso, ausência de fluxo sangüíneo ou exercício intenso. Alguns estudos apontam que possivelmente a origem das cãibras está mais relacionada com os estímulos neurais recebidos pelo músculo durante o trabalho muscular. O músculo recebe estímulos que irão sinalizar para a sua contração e relaxamento, e em uma situação normal esses sinais estão equilibrados. A cãibra seria então o resultado de um desequilíbrio desses sinais, e então o músculo ou parte dele se contrai em um momento em que ele deveria estar relaxado, daí a dor súbita e o frequente aparecimento de “nós” na musculatura afetada durante a cãibra.
As cãibras noturnas são relativamente comuns em pessoas idosas, e geralmente afetam a musculatura da panturrilha e/ou a musculatura dos pés. Uma hipótese conhecida como “hipótese do agachamento” (squatting hypothesis) sugere que o nosso hábito moderno de sentar em vez de agachar (para descansar ou para usar o banheiro, por exemplo), como o faziam os nossos ancestrais, levou a um encurtamento dos tendões dos músculos das pernas e um alongamento inadequado, o que pode ter contribuído com a tendência ao desenvolvimento de cãibras musculares nas pernas. Outros fatores que podem contribuir com a cãibra noturna são o uso de cobertores muito pesados (que atrapalhem o relaxamento adequado dos dedos dos pés) e/ou a falta do hábito de fazer exercícios de alongamento.
Musculatura cardíaca
A musculatura cardíaca, como o próprio nome sugere, está presente no coração e é responsável pelas contrações rítmicas que impulsionam a circulação sanguínea pelo corpo (figura 7). Como vimos, esse tecido também apresenta um aspecto estriado ao microscópio, devido a disposição das fibras de actina e miosina. Uma particularidade do tecido cardíaco é a sua capacidade de auto estimulação, de modo que as contrações não dependem de um estímulo direto proveniente do sistema nervoso como ocorre na musculatura esquelética. De fato, podemos observar batimentos nas células cardíacas mesmo em uma placa de cultura! (não é difícil encontrar vídeos na internet sobre isso). O SNC irá atuar no sentido de regular a frequência dos batimentos cardíacos de acordo com as necessidades imediatas do organismo: durante uma corrida o coração bate muito mais rápido do que quando estamos dormindo, por exemplo.

Figura 7 – Alguns detalhes da estrutura do tecido muscular cardíaco.
Na musculatura cardíaca observamos estruturas denominadas discos intercalares (figura 7). Elas são junções celulares especializadas que auxiliam na rápida condução do impulso elétrico ao longo do tecido e mantém as células firmemente unidas durante a forte contração do miocárdio. Outra característica das células desse tecido é a presença de um grande número de mitocôndrias para prover a energia necessária ao trabalho contínuo deste, suprindo a demanda de seu metabolismo exclusivamente aeróbio. Sendo assim, qualquer obstrução de vasos no coração que impeça a irrigação adequada de uma determinada região desse tecido pode resultar em morte celular, levando a um infarto do miocárdio (ataque cardíaco).
Musculatura lisa
A musculatura lisa guarda algumas semelhanças e diferenças com a musculatura esquelética, tanto na estrutura quanto na fisiologia da contração. As células da musculatura lisa são fusiformes e mononucleadas, formando camadas para compor o tecido (figura 8). A sua contração também depende da elevação da concentração de Ca2+ intracelular, e conta ainda com a participação de fibras de actina e miosina, porém isso não ocorre de forma idêntica a que vimos para a musculatura esquelética. Outro ponto importante é que na musculatura lisa as fibras musculares não estão organizadas em sarcômeros, por isso esse tecido não apresenta um padrão estriado ao microscópio como o músculo esquelético e o cardíaco.
Figura 8 – Aspecto geral das células da musculatura lisa. Note a torção sofrida pelo núcleo na célula contraída.

Antes do início da contração da musculatura lisa, os sítios de ligação das cabeças de miosina presentes na actina estão bloqueados por outra proteína, a caldesmona. O influxo de Ca2+ é desencadeado por um mecanismo semelhante ao que ocorre na musculatura esquelética, e estes íons se ligam a outra proteína, a calmodulina. Esse complexo calmodulina + Ca2+ promovem a dissociação da caldesmona liberando os sítios ativos da actina. A miosina então é fosforilada por uma proteína quinase, e assim essa pode interagir com a actina promovendo a contração muscular. A defosforilação da miosina promove o desacoplamento desta das fibras de actina e, consequentemente, o relaxamento muscular. A contração da musculatura lisa é mais lenta do que a da musculatura esquelética, sendo que isso está relacionado com a própria função de cada tecido. Essa musculatura é responsável pelos movimentos peristálticos ao longo do tubo digestivo, e também está presente nas paredes das artérias, atuando nas alterações de diâmetro desses vasos.
Referências
- Aires, M. M. et al. 2008. Fisiologia. 3ª ed. Guanabara Koogan;
- Alberts, et al. 2011. Biologia Molecular da Célula. 5ª ed. Artmed;
- Butler, J.V.; Mulkerrin, E. C. & O’Keeffe, S. T. Nocturnal leg cramps in older people. Postgrad Med J 2002;78:596-598.;
- Miller, K. C. et al. Initial Electrical Stimulation Frequency and Cramp Threshold Frequency and Force. Journal of Athletic Training 2012;47(6):643–647.;
- Minetto, M. A. et al. Mechanisms of cramp contractions: peripheral or central generation? J Physiol 589.23 (2011) pp 5759–773.;
- Nelson, D. L. & Cox, M. M. 2011. Princípios de Bioquímica de Lehninger. 5ª ed. Artmed;
- Triger, D. R. & Joekes, A. M. Severe Muscle Cramp due to Acute Hypomagnesaemia in Haemodialysis. British Medical Journal, 1969, 2, 804-805.
