Isaias Cavalcante de Oliveira
Introdução
“[…] O complexo de Golgi armazena a secreção” você já cantou a musiquinha das organelas no ensino médio enquanto estudava para suas provas? (Se não conhece, veja aqui: 🔗).
Quando pensamos no complexo de Golgi, geralmente o associamos ao transporte de substâncias dentro da célula ou à secreção celular, conforme sugere a música, o que está corretíssimo. No entanto, a importância do Golgi vai muito além disso. Ele também está envolvido na formação dos lisossomos, da lamela média das células vegetais, do glicocálice, participa da formação do acrossomo durante a espermatogênese e também de uma série de reações metabólicas, como a síntese de glicoproteínas, glicolipídios e esfingomielina. Vamos explorar alguns desses processos com mais detalhes adiante.
História
A descoberta do complexo de Golgi remonta ao século XIX e é creditada a Camillo Golgi (1843-1926), médico e histologista italiano. Golgi foi professor de Histologia e de Patologia Geral na Universidade de Pavia por muitos anos. Uma de suas grandes contribuições foi a invenção da impregnação metálica em 1873, que possibilitou a visualização de neurônios individuais, resultando em avanços significativos no conhecimento da estrutura do sistema nervoso. Essa técnica ficou conhecida como “reação negra”, na qual blocos de tecido nervoso eram fixados em dicromato de potássio (K2Cr2O7) por dias ou até semanas, e, em seguida, imersos em nitrato de prata (AgNO3), cujo precipitado impregnava totalmente algumas das células do tecido nervoso.
Em seus estudos, Golgi defendia a teoria reticular (reticularista), postulando que todo o sistema nervoso seria uma rede única e contínua, assemelhando-se a um grande sincício, no qual o citoplasma se misturava livremente e os sinais poderiam ser enviados em praticamente todas as direções de uma só vez. Seu contemporâneo, Santiago Ramón y Cajal (1852-1934), médico e histologista espanhol, também interessava-se pelo estudo das células nervosas e, utilizando as técnicas de Golgi, chegou a conclusões diferentes. Para Cajal, o sistema nervoso era composto por muitas células nervosas distintas (os neurônios), que se encontravam polarizadas. Ao invés de formarem uma entidade única, os neurônios comunicavam-se através de um mecanismo especializado, mais tarde chamado de sinapse. Essa teoria, conhecida como teoria neuronal, predominou com o passar dos anos e com o surgimento da microscopia eletrônica. Ambos os cientistas foram agraciados com o Prêmio Nobel de Fisiologia ou Medicina em 1906, sendo seus esforços reconhecidos pela comunidade científica global.
Enquanto estudava neurônios dos gânglios espinhais e buscava entender seu funcionamento, Golgi, em 1898, acabou descobrindo uma estrutura que denominou de “aparelho reticular interno”, a organela celular que mais tarde seria chamada de aparelho de Golgi, complexo golgiense ou simplesmente “Golgi”. Embora, nesse período, outros cientistas também relatassem a existência de estruturas reticulares em células, essa organela permaneceu associada à Universidade de Pavia, onde Golgi e seus alunos publicaram vários artigos descrevendo seu funcionamento, alterações sob diferentes condições de desenvolvimento e sua presença em vários tipos celulares. No entanto, somente com o advento da microscopia eletrônica e o desenvolvimento de técnicas de fixação e ultramicrotomia, por volta da década de 1950, a comunidade científica passou a dar maior credibilidade a essa organela. Pesquisadores como Dalton, Felix e outros publicaram micrografias eletrônicas do complexo de Golgi, uma organela que chamou a atenção devido ao seu tamanho e aspecto de rede, com muitas cisternas e vesículas.
Estrutura e função
As unidades estruturais do Golgi são denominadas cisternas, que se assemelham a sacos, delimitadas por membrana e possuem diversas vesículas (compartimentos membranosos) associadas. Para fins didáticos, podemos comparar o complexo de Golgi a uma central de correios. Da mesma forma que a central de correios recebe encomendas de outros lugares para serem enviadas aos seus destinatários, o Golgi recebe as proteínas do retículo endoplasmático (RE), as processa e as separa para serem enviadas aos seus destinos finais, incluindo a membrana plasmática, os endossomos, lisossomos ou para fora da célula. Esse caminho (RE endoplasmático -> Golgi -> vesículas secretoras) é conhecido como via secretora.
Como você provavelmente já percebeu, as “cargas” (moléculas, vesículas) que passam por essa estrutura têm um lado de entrada e um de saída. Isso significa que o Golgi é polarizado e possui regiões com estrutura e função um pouco diferentes umas das outras. Para muitos autores, esta organela é dividida em quatro regiões: a rede de Golgi cis, a pilha de Golgi (subdividida em medial e trans) e a rede de Golgi trans (Figura 1). Assim, proteínas do RE, enoveladas e montadas corretamente, assim como lipídios e polissacarídeos, são transportados para os compartimentos intermediários do RE-Golgi e, em seguida, entram no complexo de Golgi pela rede cis de Golgi (ou face cis, lado de entrada), frequentemente orientada na direção do núcleo. Elas “caminham” para os compartimentos cis, medial e trans da pilha de Golgi, onde ocorrem a maioria das atividades metabólicas do complexo de Golgi. Depois, as moléculas modificadas são movidas para a rede trans de Golgi (ou face trans, lado de saída), que age como um centro de separação e distribuição, direcionando o transporte para os endossomos, lisossomos, para a membrana plasmática ou para o exterior da célula (secreção).
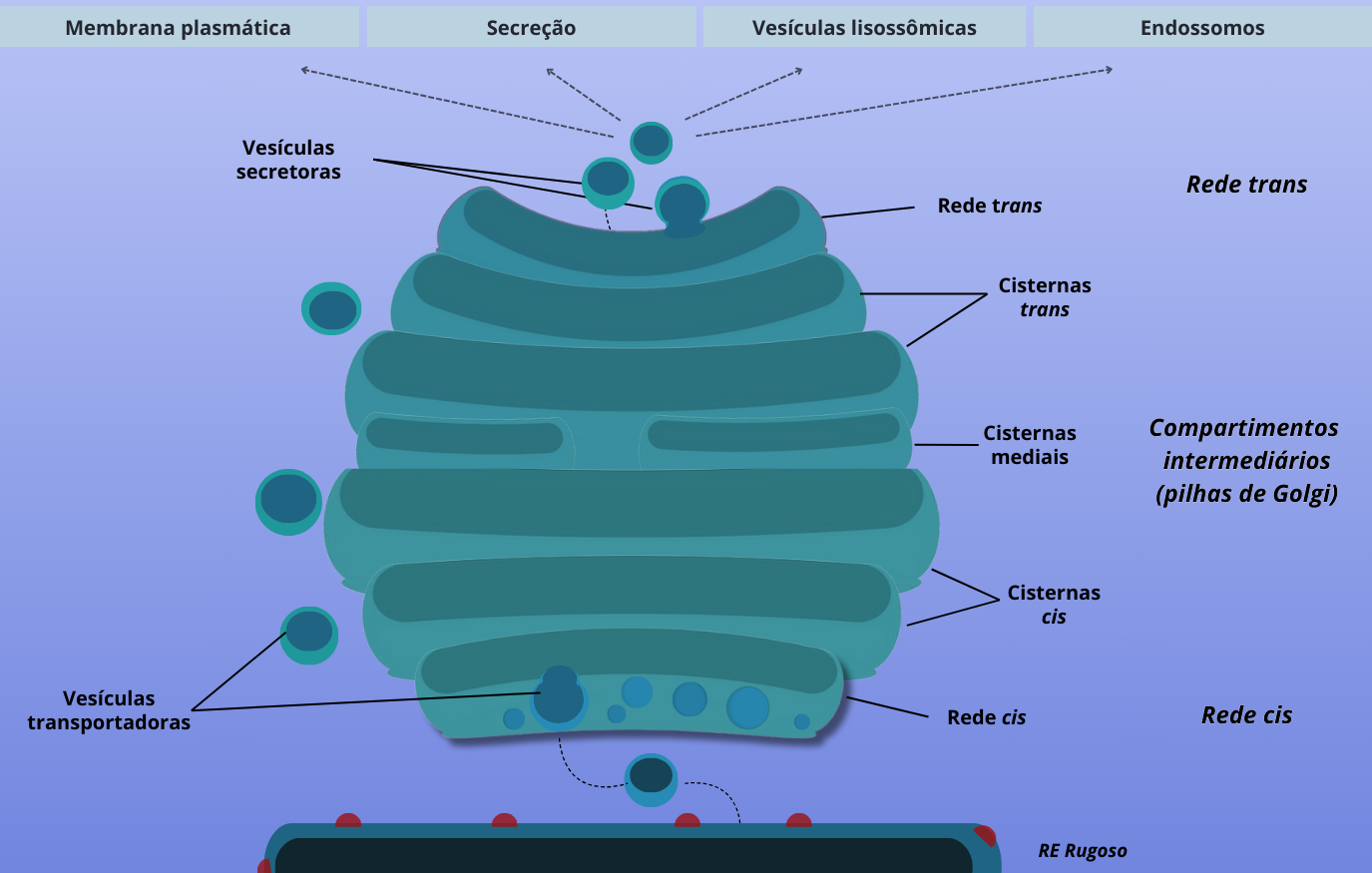
Figura 1 – Representação do complexo de Golgi. (Crédito: Isaias Cavalcante de Oliveira)
Processamento de proteínas: Glicosilação
A glicosilação é o processo no qual carboidratos (açúcares) são adicionados à superfície de proteínas e lipídios, transformando-os em glicoproteínas e glicolipídios, respectivamente. Essas moléculas desempenham papéis cruciais na estrutura das membranas biológicas, influenciando interações entre células, reconhecimento celular, constituição do glicocálice, regulação de processos imunes, crescimento celular e outros processos. Agora, vamos explorar como funciona a glicosilação de proteínas.
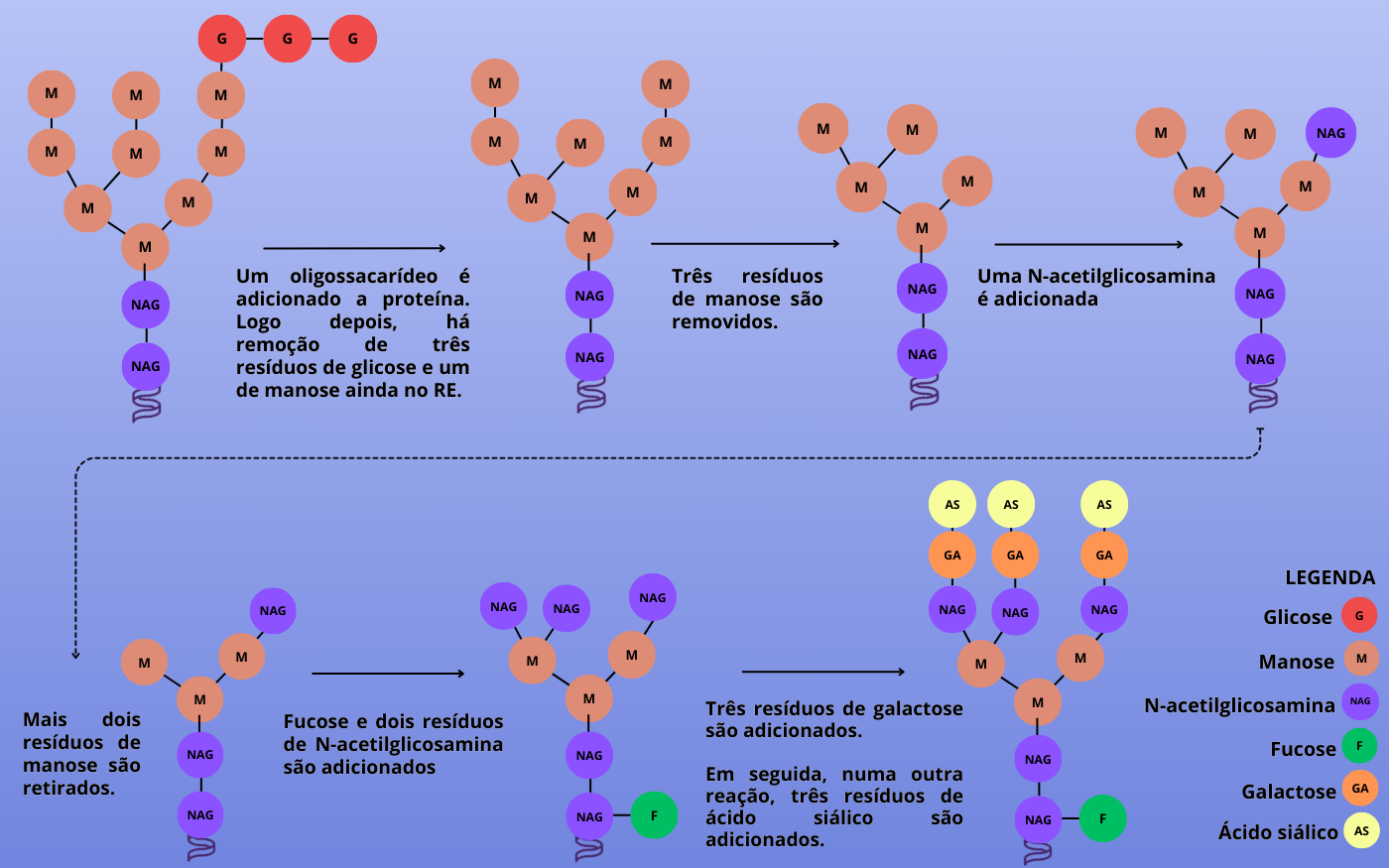
Para a maioria das proteínas, o processo de glicosilação inicia-se no Retículo Endoplasmático (RE), onde ocorrem modificações em várias etapas. Primeiramente, há a adição de um oligossacarídeo (um pequeno carboidrato) composto por 14 resíduos de açúcar. Em seguida, no RE, ocorre a remoção de três resíduos de glicose e um de manose (um carboidrato simples de seis carbonos, isômero da glicose, assim como a frutose, galactose e outros). A adição do oligossacarídeo acontece no grupo terminal amina (NH2) de um resíduo de asparagina (um aminoácido não essencial), sendo assim chamada de glicosilação tipo N. Existem também outros tipos de glicosilação, como tipo O, P, C e outros. No tipo O, um tipo bastante comum, ocorre a adição de carboidratos às cadeias laterais dos resíduos dos aminoácidos serina e treonina, em sequências específicas das proteínas.
Os oligossacarídeos dessas glicoproteínas são então transportados para as cisternas do Golgi, onde podem sofrer modificações adicionais. No Golgi, as proteínas que passaram pela glicosilação tipo N são processadas em várias etapas, dependendo de seus destinos. Aquelas destinadas à secreção ou à membrana plasmática sofrem a remoção de mais três resíduos de manose no oligossacarídeo. Em seguida, ocorre uma adição sequencial de uma N-acetilglicosamina, removendo duas manoses e adicionando uma fucose, seguida por mais duas N-acetilglicosaminas. Finalmente, três galactoses e três resíduos de ácido siálico são adicionados (ver Figura 2). Este é um panorama geral, lembrando que há uma grande variedade de modificações que as proteínas podem sofrer no Golgi, dependendo das moléculas, enzimas presentes e do tipo celular.
Figura 2 – Etapas da glicosilação de proteínas destinadas à secreção ou à membrana plasmática. A primeira etapa ocorre no Retículo Endoplasmático e as demais no Golgi. O sítio de ligação do oligossacarídeo a proteína não foi demonstrado, mas corresponde a um resíduo de asparagina (glicosilação tipo N). Baseado em COOPER & HAUSMAN, 2007. (Crédito: Isaias Cavalcante de Oliveira)
No caso dos oligossacarídeos de proteínas lisossômicas, em vez da remoção dos resíduos de manose, ocorre uma modificação por meio da fosforilação — a adição de um grupo fosfato (PO4) a uma proteína ou outra molécula — na manose. Assim, fosfatos de uma N-acetilglicosamina (UDP-NAG) são adicionados aos resíduos de manose enquanto a proteína ainda está na rede cis do Golgi. Posteriormente, o grupo N-acetilglicosamina é removido, deixando resíduos de manose-6-fosfato no oligossacarídeo. Esses resíduos fosforilados de manose não são removidos durante os processos subsequentes e são reconhecidos por um receptor de manose-6-fosfato na rede trans do Golgi. Esse receptor direciona o transporte dessas proteínas para os lisossomos.
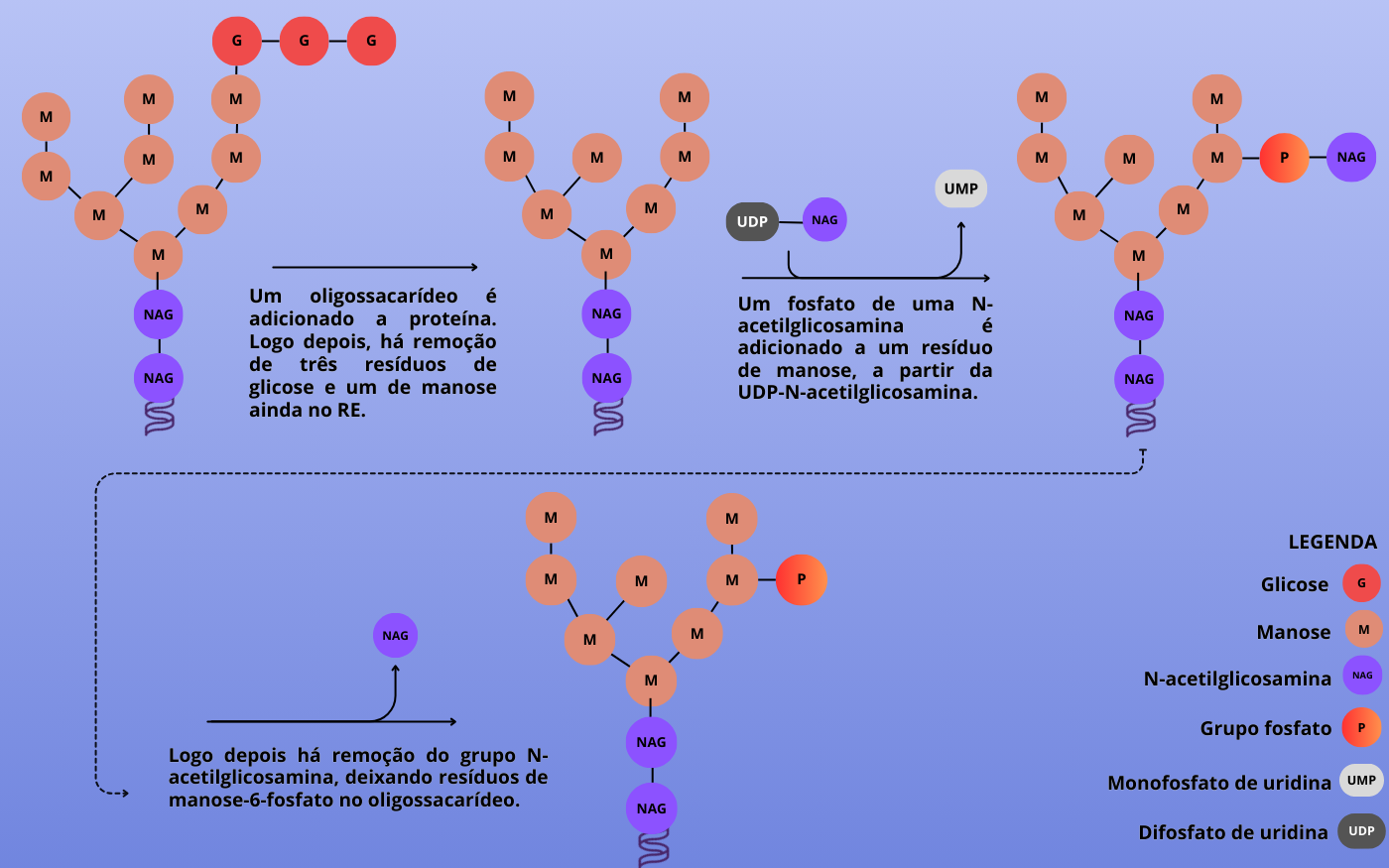
Figura 3 – Etapas da glicosilação de proteínas destinadas os lisossomos. A fosforilação direciona o transporte das proteínas para os lisossomos. A primeira etapa ocorre no Retículo Endoplasmático e as demais no Golgi. Baseado em COOPER & HAUSMAN, 2007. (Crédito: Isaias Cavalcante de Oliveira)
Metabolismo de Lipídeos e Polissacarídeos no Golgi
O complexo de Golgi desempenha um papel crucial no metabolismo de lipídios, especialmente na síntese de glicolipídios e esfingomielina. Para compreendermos melhor, recordemos um pouco sobre a estrutura dos lipídios. Os lipídios consistem em ácidos graxos, que são cadeias carbônicas com um grupo carboxila (-COOH) na extremidade, podendo ser saturados ou insaturados. No entanto, raramente encontramos ácidos graxos livres nos organismos. Eles geralmente estão ligados a um álcool, que pode ser o glicerol ou a esfingosina. No primeiro caso, chamamos essas moléculas de triacilgliceróis (glicerol + ácidos graxos) e glicerofosfolipídeos (glicerol + fosfato + ácidos graxos e um álcool). No segundo caso, temos os esfingolipídios (esfingosina + ácido graxo e algum radical). Quando esse radical é um hidrogênio, chamamos a molécula resultante de ceramida, conhecida por ser um componente importante para a saúde da pele e por ser utilizada em cremes para a pele e cabelo. Além disso, há outros tipos de lipídios, como o colesterol, um esteroide precursor de vários hormônios, caracterizado por quatro anéis no centro da molécula. Até aqui, tudo claro?
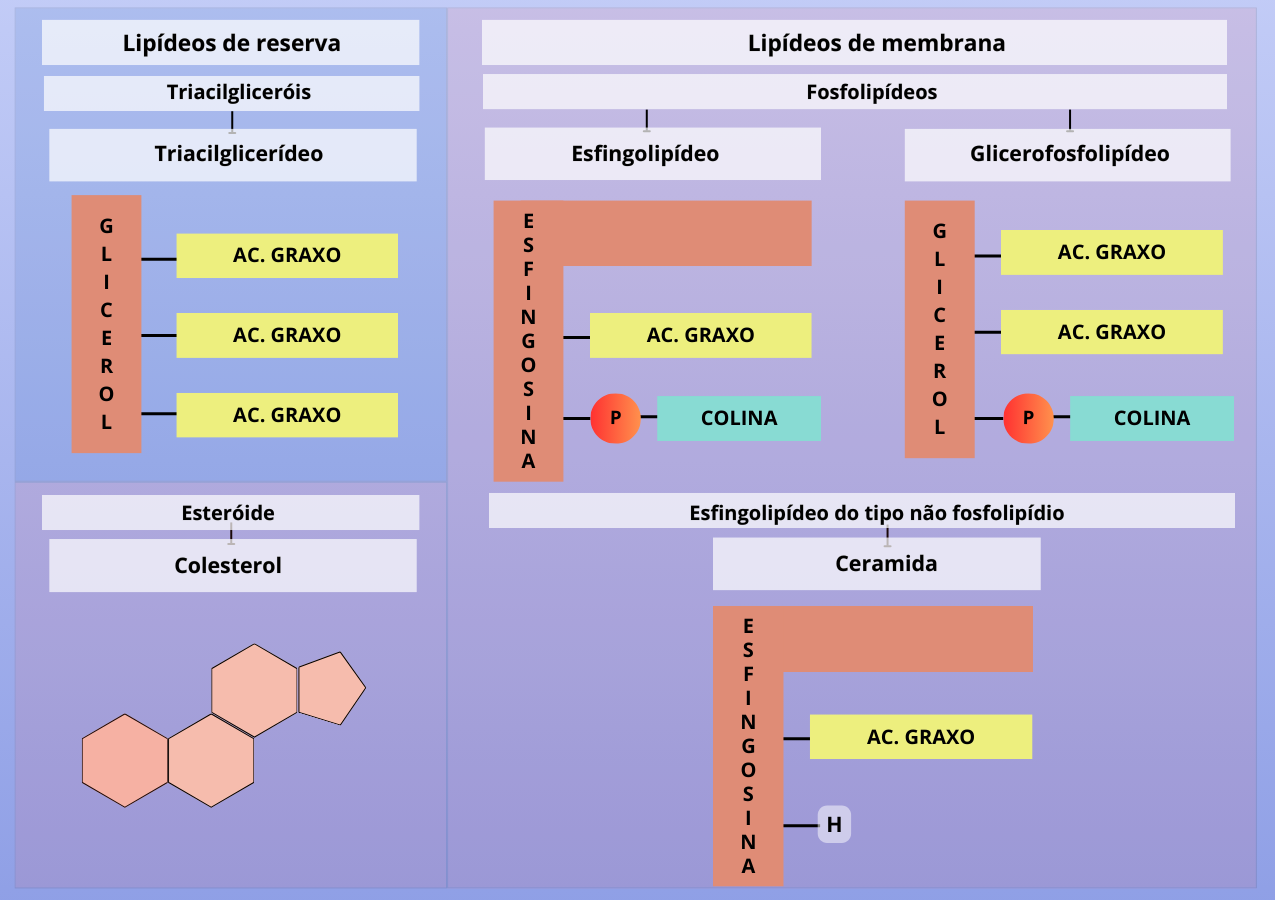
Figura 4 – Estrutura de lipídios. As ligações químicas não foram representadas. Baseado em MARZZOCO & TORRES, 2022. (Crédito: Isaias Cavalcante de Oliveira)
Os glicerofosfolipídeos, o colesterol e a ceramida são sintetizados no Retículo Endoplasmático (RE). A partir da ceramida, podem ser sintetizadas a esfingomielina (um esfingolipídio) e os glicolipídios no complexo de Golgi. A síntese de esfingomielina ocorre no lúmen do Golgi, enquanto a glicose é adicionada à ceramida no lado citosólico. Carboidratos adicionais são incorporados às moléculas no lado do lúmen da membrana. Isso ocorre porque a esfingomielina e os glicolipídios não conseguem atravessar a membrana do Golgi, sendo encontrados apenas na face luminal da bicamada do Golgi. Após o transporte vesicular, essas moléculas localizam-se na porção exterior da membrana plasmática, expondo suas cabeças polares na superfície celular.
Distribuição de Proteínas e exportação do Complexo de Golgi
As moléculas (proteínas, lipídeos e polissacarídeos) são transportadas do complexo de Golgi para os locais apropriados na célula através da via secretora, utilizando as vesículas transportadoras da rede trans do Golgi. No entanto, existem diferentes caminhos para esse transporte. A via mais comum é a constitutiva, na qual essas moléculas são carregadas do Golgi e incorporadas na membrana, assim como secretadas pela célula, independentemente de sinais ou fatores externos. Esse processo torna-se ainda mais interessante em células polarizadas, pois as moléculas são destinadas diretamente aos domínios apical e basal/basolateral.
Outras moléculas seguem uma via de secreção regulada, sendo transportadas para a superfície celular ou direcionadas para destinos intracelulares específicos, como lisossomos em células animais ou vacúolos em leveduras e plantas. Essa via regulada oferece uma certa “precisão” temporal na liberação de vesículas, uma vez que algumas só são liberadas em resposta a estímulos externos ou sinalizações intracelulares. Um exemplo é a liberação de insulina, estimulada pelo aumento do conteúdo de glicose no sangue após uma refeição. Outros exemplos incluem a liberação de hormônios endócrinos, neurotransmissores e enzimas digestivas dos ácinos pancreáticos.
Além disso, é importante mencionar as proteínas que atuam dentro do próprio Golgi. Ao contrário das demais, que são solúveis no lúmen, as proteínas retidas dentro do complexo de Golgi ficam associadas à sua membrana. Certos sinais em sequências transmembranares dessas proteínas as impedem de serem empacotadas em vesículas de transporte que deixam a rede trans do Golgi . Existem também sinais, como as sequências KKXX e KDEL, além de sinais nas extremidades citoplasmáticas de algumas proteínas do Golgi, que indicam proteínas capazes de percorrer a via secretora no sentido de retorno ao Retículo Endoplasmático.
Transporte vesicular e formação dos lisossomos e do acrossomo
Existe uma ampla diversidade de vesículas transportadoras nas células, sendo a maioria revestida por proteínas acessórias que conferem forma à vesícula e selecionam a carga a ser transportada. Dentre essas proteínas, três tipos são mais comuns: clatrina, COPI e COPII. As vesículas revestidas por clatrina realizam o transporte a partir da rede trans do Golgi, endossomos e da membrana plasmática, enquanto as vesículas revestidas por COPI e COPII medeiam, mais frequentemente, o transporte a partir do Retículo Endoplasmático e das cisternas do Golgi.
Quando há um transporte no sentido de secreção (anterógrado) a partir do Retículo Endoplasmático, as vesículas são revestidas por COPII, enquanto as que carregam proteínas do Golgi para o RE são recobertas por COPI, atuando no sentido retrógrado. Durante esse processo, as vesículas podem se fundir, sendo auxiliadas por proteínas SNAREs, e recebem o nome de agrupamentos tubulares de vesículas. Muitas dessas proteínas de revestimento são reaproveitadas pelas células. O processo é complexo, envolvendo proteínas adaptadoras, de curvatura, de fusão de membrana, citoplasmáticas, do citoesqueleto e recrutadoras de revestimento (ARF, Sar1), que utilizam GTP como fonte de energia. Tudo isso assegura o transporte eficiente e correto das moléculas de carga (bem mais do que o transporte público do meu bairro!).
O Golgi também desempenha papel na formação dos lisossomos, organelas geralmente esféricas, mas que podem assumir diferentes formas e tamanhos. Estas estão envolvidas na digestão celular, degradando diversas biomoléculas (proteínas, lipídeos, carboidratos, ácidos nucleicos) com a ajuda de enzimas hidrolíticas, atuando em um pH ácido (próximo de 5) mantido no lúmen do lisossomo. Nas células animais, o complexo de Golgi contribui para a formação do acrossomo, uma estrutura que contém enzimas para perfurar o revestimento do ovócito durante a fecundação. O acrossomo tem forma de uma vesícula e localiza-se na parte anterior da cabeça do espermatozoide, facilitando a liberação de enzimas hidrolíticas para a zona pelúcida do ovócito, em um processo conhecido como reação acrossômica. Por fim, a ilustração abaixo sintetiza tudo o que discutimos até agora (Figura 5).
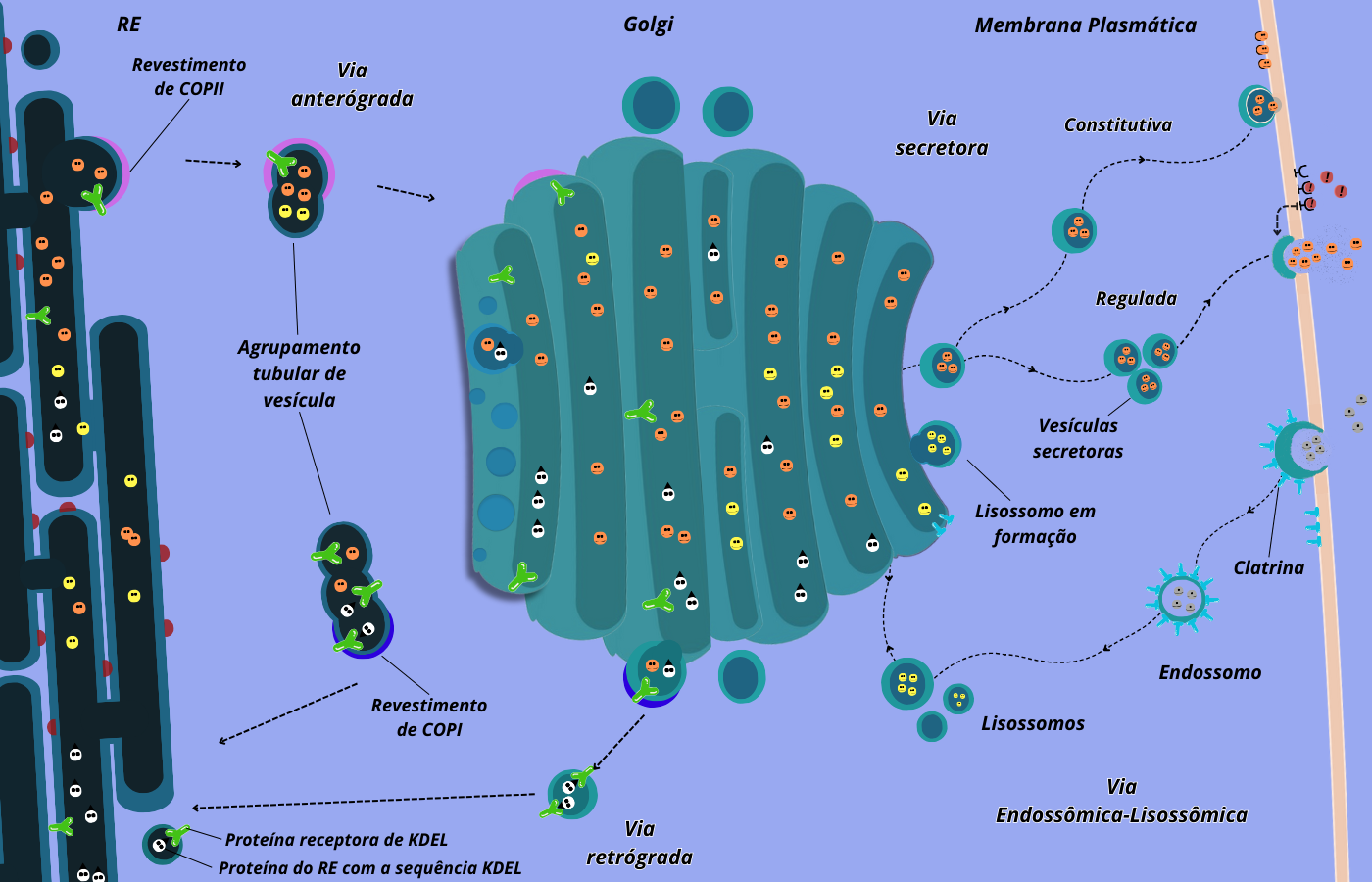
Figura 5 – Resumo do transporte vesicular e vias. As bolinhas laranjas representam proteínas de secreção, as brancas proteínas com sequência KDEL (retorno ao RE) e as amarelas proteínas destinadas aos lisossomos. As moléculas que saem do RE chegam ao Golgi passando por vesículas intermediárias, revestidas com COPII (rosa) e seus agrupamentos (sentido anterógrado). No Golgi as vsículas vão sendo deslocadas no sentido rede cis -> cisternas cis, mediais e trans -> rede trans, onde podem seguir alguns caminhos. No sentido de secreção, podem seguir pela via constitutiva (1) onde tais moléculas são carregadas do Golgi e incorporadas na membrana ou como secretadas pela célula, independentemente de sinais ou fatores externos. Ou podem transportadas para a superfície celular pela via de secreção regulada (2), podendo também ser direcionadas especificamente para outros destinos intracelulares, como lisossomos ou vacúolos. Um outro caminho, no sentido contrário, é retornar do Golgi e outros compartimentos pela via de recuperação, sendo levados por vesículas com COPI (azul escuro), onde tais moléculas são reconhecidas por suas sequências sinais. Ainda, moléculas do exterior da célula podem ser incorporadas pela célula (endocitose) e seguir para os lisossomos, sendo digeridas e esses produtos residuais da digestão aproveitados pela célula. Baseado em Alberts et al., 2017. (Crédito: Isaias Cavalcante de Oliveira)
Golgi e as plantas: Formação de celulose e lamela média
O Golgi e o sistema de endomembranas desempenham um papel crucial na produção de celulose nas plantas. A celulose é o principal componente da parede celular das plantas, conferindo forma e suporte à célula vegetal, além de protegê-la contra patógenos. Trata-se de um carboidrato linear formado por várias unidades de glicose. A celulose é produzida nas plantas por complexos de celulose sintase (CSCs, do inglês cellulose synthase complex), conjuntos enzimáticos produzidos no retículo endoplasmático e, até onde sabemos, agrupam-se no aparelho de Golgi, onde formam rosetas. Após a montagem, esses complexos são direcionados à membrana plasmática através da rede trans do Golgi, onde são ativados e iniciam a síntese de celulose. Estudos indicam que, além de alguns genes (como IRX1 e IRX3), duas proteínas STL (STELLO) 1 e 2, localizadas no Golgi, são necessárias para a montagem e distribuição adequadas dos CSCs em células vegetais, juntamente com microtúbulos e actomiosina.
Ademais, muitos polissacarídeos da parede celular são sintetizados no aparelho de Golgi antes de serem secretados para o apoplasto. Por exemplo, o Golgi desempenha um papel crucial na formação da lamela média durante a divisão celular vegetal, sendo uma estrutura composta por pectina e polissacarídeos, cuja principal função é manter as células vegetais unidas, atuando como uma espécie de “cimento”. Vale ressaltar que a maioria das células vegetais possui centenas de pilhas de Golgi independentes dispersas pelo citoplasma, ao contrário das células animais, onde essas pilhas são menos numerosas, interligadas e um pouco maiores. Cada pilha pode ser denominada de dictiossomo.
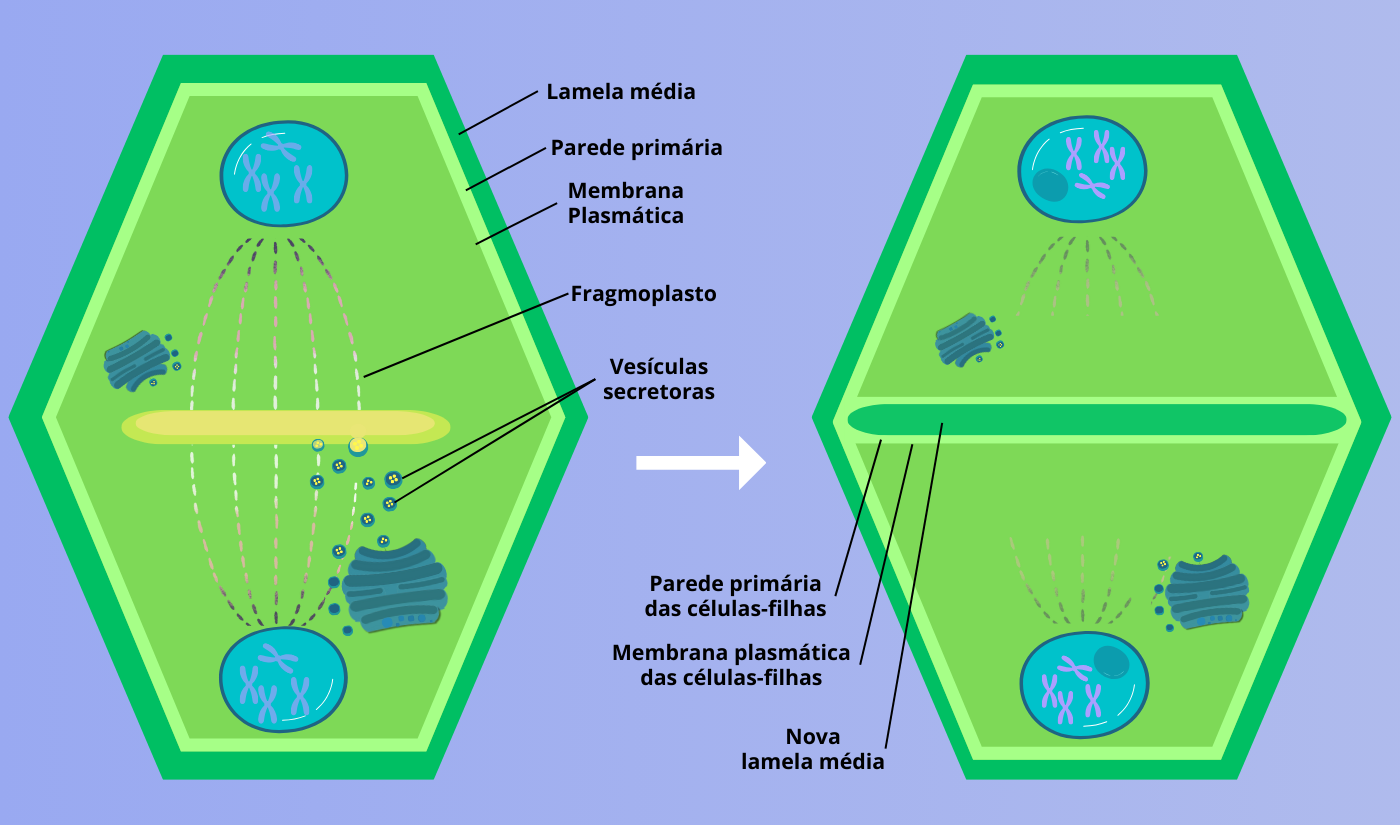
Figura 6 – Formação da lamela média. Ao final da divisão celular, começa a surgir o fragmoplasto, conjunto de microtúbulos que orientam vesículas do Golgi dando origem a uma placa celular no centro da célula-mãe. Essa placa se expande e dá origem à lamela média e as respectivas paredes celulares primárias das células-filhas, ao redor de suas membranas. Baseado em BALADA, 2021. (Crédito: Isaias Cavalcante de Oliveira)
Golgi no transporte e armazenamento de íons
O complexo de Golgi, também conhecido como aparelho de Golgi, desempenha um papel fundamental no transporte de íons de zinco (Zn2+) e sua incorporação em proteínas, por meio dos transportadores ZIP e das proteínas transportadoras de zinco, ZnTs. Os transportadores ZIP são responsáveis pelo transporte de zinco para o citoplasma, seja a partir do espaço extracelular (influxo) ou do interior de organelas intracelulares (efluxo). Por outro lado, as proteínas ZnTs retiram o zinco do citoplasma, transportando-o para fora das células ou para o interior de organelas.
O zinco é um componente essencial de mais de 300 enzimas, incluindo a álcool desidrogenase (envolvida no metabolismo do álcool etílico), superóxido dismutase (importante na defesa antioxidante em muitas células) e anidrase carbônica (essencial no transporte de CO2 e controle do pH sanguíneo). Em células específicas, como as células β do pâncreas para o empacotamento da insulina e células α para a regulação da secreção de glucagon, nas células epiteliais da próstata para a secreção de citrato, e nas células epiteliais mamárias para a lactação (ver Figura 7), o zinco desempenha funções vitais. Vale destacar que essas células fazem parte de tecidos especializados em secreção.
Assim como o retículo endoplasmático, o Golgi também atua como um reservatório para íons de cálcio (Ca2+), um elemento crucial para a sinalização celular, coagulação sanguínea, contração muscular e transmissão de impulsos nervosos. No interior dessa organela, encontram-se diversos canais de liberação de Ca2+, proteínas de ligação de Ca2+, e ATPases transportadoras de Ca2+. Essas ATPases também exibem afinidade para o manganês (Mn2+), um íon associado a muitas enzimas de glicosilação. Similarmente, o Golgi transporta íons de cobre (Cu2+), um elemento que atua como cofator e regulador de diversas enzimas, incluindo a citocromo c oxidase (parte da cadeia transportadora de elétrons), aminoxidases, proteína-lisina 6-oxidase, entre outras. O transporte desses íons é facilitado pelas proteínas ATP7A e ATP7B presentes na membrana do Golgi.
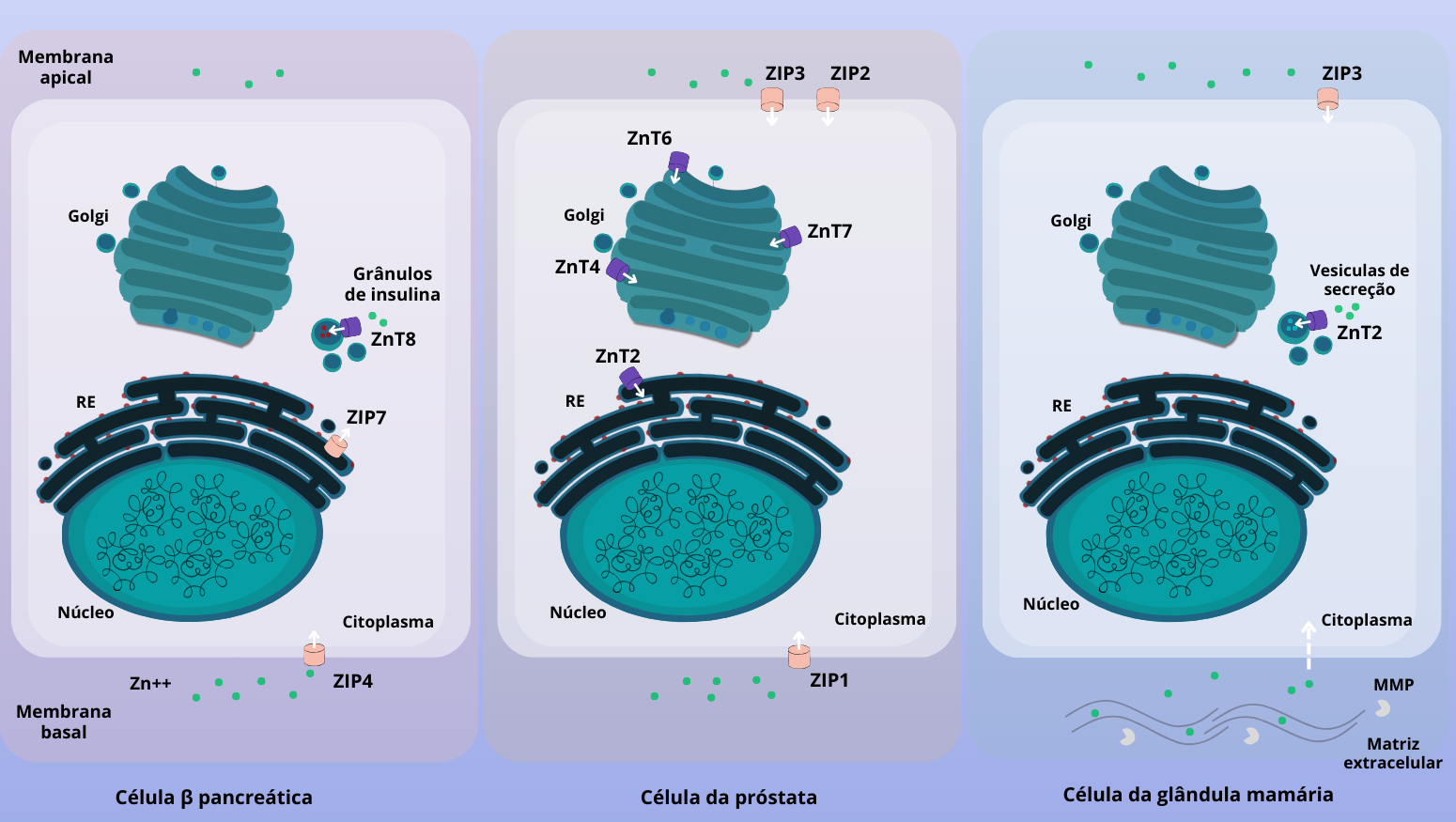
Figura 7 – Representação simplificada de alguns transportadores de zinco conhecidos em três tipos celulares. O zinco (Zn2+) é ilustrado em bolinhas verdes e as direções do transporte são mostradas por meio das setas. A) Célula β pancreática. O Zn é transportado para as células β pancreáticas via Zip4. Zip7 atua transportando o zinco do RE para o citoplasma (também já foi encontrado no Golgi). ZnT8 é responsável pelo transporte de Zn para os grânulos de insulina. B) Célula epitelial da próstata de um rato (lobo lateral). Zip2 e Zip3 estão localizados na membrana apical e Zip1 na membrana basal. ZnT4, ZnT6 e ZnT7 estão localizados no aparelho de Golgi e ZnT2 está no RE. Esses transportadores provavelmente mantêm via secretora funcionando. C) Células epitelial da glândula mamária. Durante a lactação, o ZnT2 desempenha um papel importante na secreção de Zn no leite, enquanto o Zip3 está relacionado à recaptação de Zn do lúmen. A localização e contribuição de outros transportadores de Zn nesse tecido ainda não foi totalmente elucidada. Os “pacmans”, metaloproteínases de matriz, (MMP do inglês matrix metalloproteínases) são enzimas dependentes de Zn que degradam a matriz extracelular e facilitam a remodelação do tecido mamário durante a lactação. Baseado em KELLEHER et al. 2011; JEONG & EIDE, 2013; BUI et al. 2023; KAMBE et al. 2021. (Crédito: Isaias Cavalcante de Oliveira)
O Golgi e patologias
Para concluir, podemos discutir algumas implicações do mau funcionamento do Golgi e/ou de suas proteínas. Uma patologia relativamente rara e pouco conhecida é a doença de Wilson, caracterizada pelos altos níveis de cobre no sangue. Esta doença autossômica recessiva ocorre devido a mutações no gene ATP7B, localizado no cromossomo 13. A proteína codificada por esse gene reside nas cisternas do Golgi dos hepatócitos, sendo responsável pelo transporte e ligação dos íons de cobre à apoceruloplasmina, que se converte em ceruloplasmina, uma glicoproteína do fígado contendo seis átomos de cobre por molécula. A ceruloplasmina torna-se a principal forma de transporte de cobre no sangue. A proteína ATP7B também direciona o metal para o endossomo e lisossomo, promovendo sua excreção na bile. Alterações nesta proteína resultam em transporte inadequado e menor incorporação de cobre na ceruloplasmina, levando ao acúmulo desse mineral em tecidos como fígado, sistema nervoso central, córneas e rins. Em algumas pessoas, um dos principais sinais é o surgimento de anéis dourados ou esverdeados (anéis de Kayser-Fleischer) ao redor da íris, quando ocorre o acúmulo de cobre. A nível celular, observa-se a formação de espécies reativas de oxigênio, aumento de fatores inflamatórios, disfunção mitocondrial, entre outros efeitos.
Sob condições de estresse oxidativo, farmacológico ou desequilíbrio iônico, pode ocorrer a fragmentação do Golgi, dispersando suas cisternas e vesículas. Durante esse evento, vias de reparo são acionadas pelas células, e proteínas sinalizadoras entram em ação. Essa fragmentação é frequentemente um sinalizador precoce de doenças neurodegenerativas, como a doença de Parkinson e a doença de Alzheimer. Na doença de Parkinson, essa fragmentação leva ao acúmulo de alfa-sinucleína e outras moléculas que podem ser tóxicas, resultando na morte dos neurônios. Um processo semelhante ocorre com a proteína β-amiloide na doença de Alzheimer. Além disso, mutações genéticas podem resultar na produção de proteínas defeituosas que interferem no trânsito vesicular, e disfunções no complexo de Golgi também estão associadas a doenças como esclerose lateral amiotrófica, doença de Huntington, síndrome de Hermansky-Pudlak e cânceres. Doenças lisossomais são abordadas em outro módulo (Doenças de Armazenamento Lisossômico 🔗).
Referências
- ALBERTS, B. et al. 2017. Biologia Molecular da Célula. 6ª ed. Artmed
- ARAÚJO, Thiago Ferreira de. Importância da detecção de mutações do gene ATP7B para o diagnóstico da doença de Wilson. 2014. Tese (Doutorado em Ciências em Gastroenterologia) – Faculdade de Medicina, Universidade de São Paulo, São Paulo, 2014. doi:10.11606/T.5.2014.tde-14082014-091501
- BALADA, FRANCESCA. FRAGMOPLASTO: definición y función – RESUMEN. UNPROFESOR. 26 de jan de 2021. https://www.unprofesor.com/ciencias-naturales/fragmoplasto-definicion-y-funcion-4613.html
- BENTIVOGLIO M, et al. The Original Histological Slides of Camillo Golgi and His Discoveries on Neuronal Structure. Front. Neuroanat. 13:3. 2019. DOI: 10.3389/fnana.2019.00003
- BUI, H. B. et al. Cryo-EM structures of human zinc transporter ZnT7 reveal the mechanism of Zn2+ uptake into the Golgi apparatus. Nature Communications, v. 14, n. 1, p. 4770, 8 ago. 2023.
- DE CASTRO, F. Cajal and the Spanish Neurological School: Neuroscience Would Have Been a Different Story Without Them. Frontiers in Cellular Neuroscience. 13. (2019) DOI: 10.3389/fncel.2019.00187 .
- COOPER, G. M.; HAUSMAN, R. E. A Célula, Uma Abordagem Molecular. 3 ª ed. Porto Alegre: Artmed, 2007.
- COSTA, D. C. DA et al. Compostos bioativos e seus alvos terapêuticos com propriedade Anti-Alzheimer: Uma revisão da literatura. Revista Arquivos Científicos (IMMES), v. 2, n. 2, p. 133–156, 16 dez. 2019. https://arqcientificosimmes.emnuvens.com.br/abi/article/view/229/91
- JEONG, J.; EIDE, D. J. The SLC39 family of zinc transporters. Molecular Aspects of Medicine, v. 34, n. 2-3, p. 612–619, abr. 2013. DOI: 10.1016/j.mam.2012.05.011
- KAMBE, T.; TAYLOR, K. M.; FU, D. Zinc transporters and their functional integration in mammalian cells. Journal of Biological Chemistry, v. 296, 1 jan. 2021.
- KELLEHER, S. L. et al. Zinc in Specialized Secretory Tissues: Roles in the Pancreas, Prostate, and Mammary Gland. Advances in Nutrition, v. 2, n. 2, p. 101–111, 1 mar. 2011. https://doi.org/10.3945/an.110.000232
- LI, J.; WANG, Y. Golgi Metal Ion Homeostasis in Human Health and Diseases. Cells, v. 11, n. 2, p. 289, 15 jan. 2022. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8773785/
- LIU, L. et al. Actomyosin and CSI1/POM2 cooperate to deliver cellulose synthase from Golgi to cortical microtubules in Arabidopsis. Nature Communications, v. 14, n. 1, p. 7442, 17 nov. 2023. https://www.nature.com/articles/s41467-023-43325-9
- MAFRA, D.; COZZOLINO, S. M. F. Importância do zinco na nutrição humana. Revista de Nutrição, v. 17, n. 1, p. 79–87, mar. 2004.
- MARZZOCO, A.; TORRES, B.B. Bioquímica Básica, 4ª ed. [Reimpr.]. Guanabara Koogan, 2022.
- MOHAN, A. G. et al. The Golgi Apparatus: A Voyage through Time, Structure, Function and Implication in Neurodegenerative Disorders. Cells, v. 12, n. 15, p. 1972, 1 jan. 2023. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10417163/
- SCHNEIDER, M.; AL-SHAREFFI, E.; HALTIWANGER, R. S. Biological functions of fucose in mammals. Glycobiology, v. 27, n. 7, p. 601–618, 1 jul. 2017. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5458543/
- SÓCIO, S. DE A. et al. Doença de Wilson em crianças e adolescentes: como fazer diagnóstico precoce. rmmg.org, v. 19, n. 4, p. 35–41, [s.d.].
- TAYLOR, N. G.; LAURIE, S.; TURNER, S. R. Multiple Cellulose Synthase Catalytic Subunits Are Required for Cellulose Synthesis in Arabidopsis. The Plant Cell, v. 12, n. 12, p. 2529–2539, 1 dez. 2000.
- ZHANG, Y. et al. Golgi-localized STELLO proteins regulate the assembly and trafficking of cellulose synthase complexes in Arabidopsis. Nature Communications, v. 7, n. 1, 9 jun. 2016. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4906169/
