Dra. Maíra Estanislau Soares de Almeida
Matriz extracelular intersticial
É considerada matriz intersticial toda a parte mais abundante da matriz extracelular (MEC) e, como o próprio nome já diz, encontra-se no interstício (entre duas partes), principalmente em tecidos conjuntivos. Apresenta composições variadas de macromoléculas e vários tipos celulares, o que determina as propriedades físicas de cada tecido.
Funcionalmente, atuam como componentes estruturais que dão suporte às células que compõem esse microambiente, principalmente os fibroblastos. Ainda armazenam os produtos sintetizados por eles como fatores solúveis, moléculas biologicamente ativas como proteinases, citocinas e fatores de crescimento.
Os fibroblastos são as principais células que compõem a matriz extracelular. Eles são células usualmente conhecidas pela sua associação com os feixes de fibras colágenas, e também são responsáveis por sintetizar, organizar e degradar os diversos componentes dos elementos fibrosos da MEC como fibronectina, elastina e proteoglicanos.
Didaticamente, podemos dividir a composição da matriz intersticial em:
- Proteínas fibrosas (p ex.: colágenos e elastina);
- Proteínas multiadesivas (p ex.: fibronectina);
- Proteoglicanos e glicosaminoglicanos.
Também, é importante lembrar que as proteínas de matriz extracelular interagem com as células através de proteínas que fazem a comunicação célula-matriz extracelular, como por exemplo, as integrinas. Abordaremos sucintamente cada um dos componentes, quanto a sua função e localização nos mais diversos tecidos e órgãos. É importante citar que cada proteína que está presente é organizada nos tecidos de acordo com a função que desempenha.
O colágeno é a proteína mais abundante encontrada no corpo humano. Existem os colágenos fibrilares, colágenos associados a fibrilas, colágenos de ancoragem e colágenos transmembranares. Cada um desses pertence à sua classe, por causa das funções que desempenham.
Por exemplo, o colágeno tipo I faz parte dos colágenos fibrilares. Esses colágenos se agregam de maneira bem organizada o que confere resistência à tensão, por isso estão presentes na pele, tendões, ligamentos e dentina, estruturas que precisam ser duras ou resistir à tensão. Normalmente, as fibrilas de colágeno tipo I são formadas por mais um tipo de colágeno, como os do tipo III e tipo V.
Um exemplo na presença de colágeno tipo I é o tecido conjuntivo propriamente dito, seja o denso ou o frouxo. Na pele, na região da derme mais profunda, por exemplo, possui tecido conjuntivo denso não modelado composto principalmente por colágeno tipo I.
Outro exemplo é a dentina madura, que é composta por 70% de material inorgânico- hidroxiapatita e na face orgânica 90% de colágeno tipo I com pequenas quantidades do tipo III e tipo V.
Já o tecido adiposo unilocular apresenta septos de tecido conjuntivo que são responsáveis por armazenar nervos e vasos. Principalmente esses septos são formados por colágeno tipo III.
O colágeno tipo VII pertence aos colágenos que formam fibrilas de ancoragem e possui forma característica de feixes feitos de dímeros ancorados à lâmina basal, traduzindo força epitelial na junção com o tecido conjuntivo, presente no epitélio.

Figura 1
Créditos: Edilson Jacob
Outro exemplo da presença de MEC em tecidos é no tecido ósseo. O osso é um tipo de tecido conjuntivo especializado rígido e inflexível no qual sua MEC foi impregnada com sais de magnésio e cálcio, num processo chamado de mineralização. Conhecida como matriz óssea, esta é composta por componentes orgânicos- como colágeno tipo I e proteoglicanos ricos em condroitinsulfato, queratansulfato e ácido hialurônico; e inorgânicos- como fosfato de cálcio.
A cartilagem hialina é formada por fibrilas de colágeno tipo II associadas a ácido hialurônico, proteoglicanos e glicoproteínas. Já a cartilagem elástica é composta por colágeno do tipo II e elastina. A elastina é uma glicoproteína produzida principalmente por fibroblastos e células musculares lisas. Possuem características elásticas, o que conferem aos órgãos que possuem elasticidade, como a orelha e a epiglote.
A elastina também é muito importante na composição da camada mais interna das artérias – a túnica íntima-. Como sabemos funcionalmente, as artérias são responsáveis por conduzir o sangue do coração para os capilares. Assim, a presença da elastina da parede das artérias é importante na variação do calibre de acordo com o fluxo sanguíneo.
Também, a elastina que compõem as fibras elásticas são componentes importantes das paredes dos bronquíolos e dos alvéolos. A perda da elasticidade e a degradação das fibras elásticas originam o enfisema, caracterizado pela obstrução crônica do fluxo de ar.
Os principais produtores de colágeno são células mesenquimais e outros derivados como fibroblasto, condrócitos, osteoblastos, odontoblastos e cementoblastos. Ainda, outras células como epiteliais, endoteliais musculares e de Schwann, também tem a capacidade de produzir colágeno, embora limitada em relação a variedade e quantidade.
Mas, sabe-se que a matriz extracelular interage com as células que compõem os tecidos. Essa interação das células pode ser umas com as outras diretamente ou indiretamente através de moléculas de adesão celular (CAM). Existe um grande número de CAMs que se classificam em 4 famílias: caderinas, imunoglobulinas, integrinas e selectinas.
Importantes para nós nesse tópico são as integrinas, que são proteínas integradas na membrana celular que são responsáveis por esta conversa entre célula e matriz extracelular. São heterodímeros formados por cadeia α e β que pode combinar-se em pelo menos 24 maneiras, gerando uma diversidade muito grande.
As integrinas podem mediar interações célula-célula em tecidos epiteliais, como por exemplo α6β4 que está expressa em células epiteliais e presente em junções do tipo hemidesmossomos. Exercem papel importante na adesão dessas células à membrana basal adjacente para fazer contato com o tecido conjuntivo.
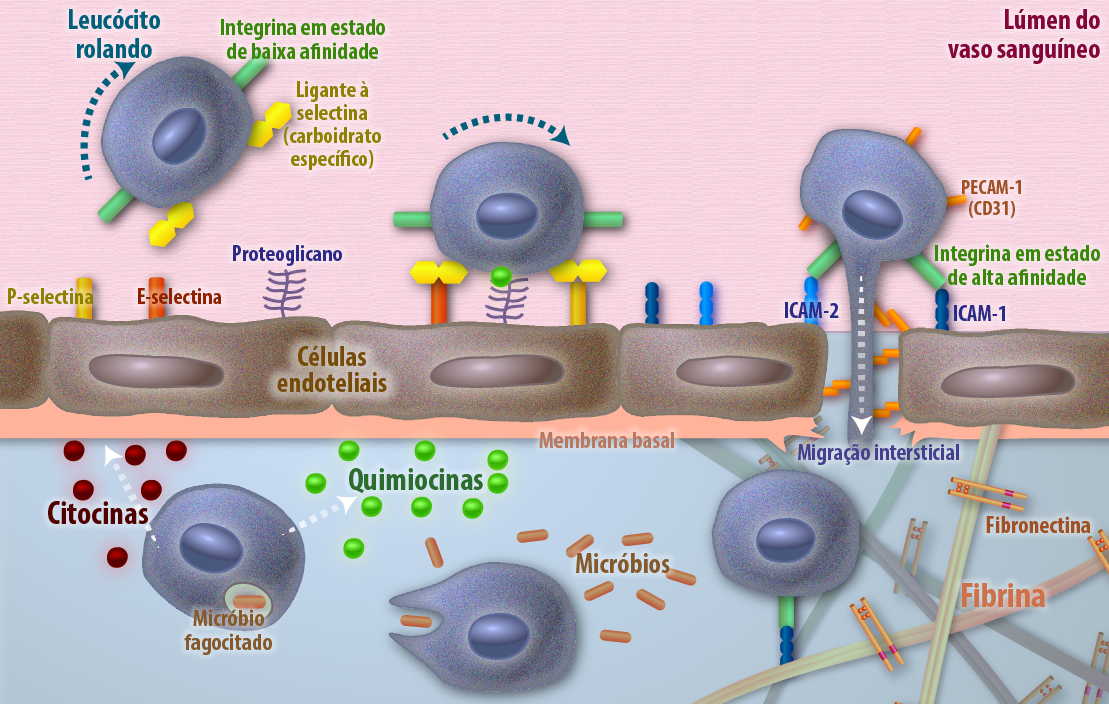
Figura 2
Créditos: Edilson Jacob
Ainda, as integrinas podem realizar funções de ligação entre célula-matriz em tecidos não epiteliais. Interessantemente, a ligação de células aos componentes da MEC pode ser modulada pelo número de moléculas de integrinas expostas na superfície celular, fenômeno que pode ser regulado pela necessidade (sinalização) da célula. Um exemplo é a integrina α4β1 presentes em células hematopoiéticas (precursoras de leucócitos e hemácias). Para proliferar e diferenciar, essas células precisam que esta integrina esteja ativa e ligada à fibronectina, componente da MEC da medula óssea. Uma vez ali ancoradas, e após a proliferação e diferenciação, o estímulo cessa, as integrinas não inativadas e ocorre uma redução no número delas expressas na superfície celular, o que permitem que as células sanguíneas maduras liberem-se na matriz e entrem na circulação sanguínea.
A fibronectina é uma proteína multiadesiva que pode ser produzida por diversos tipos celulares. Auxilia a ligação das células com a MEC, através da ligação com outros componentes da MEC como colágenos e proteoglicanos como o sulfato de heparan. Ainda, a fibronectina auxilia a ligação desses componentes à receptores de superfície como as integrinas. A fibronectina é formada por um dímero de dois polipeptídios similares ligados em porções C-terminais por duas pontes de sulfeto. Cada cadeia do polipeptídio é composta por seis regiões distintas com diferentes especificidades de ligação. Por isso, a classificação de fibronectina como proteínas multiadesivas. Dessa forma, a fibronectina pode ligar as células com a MEC.
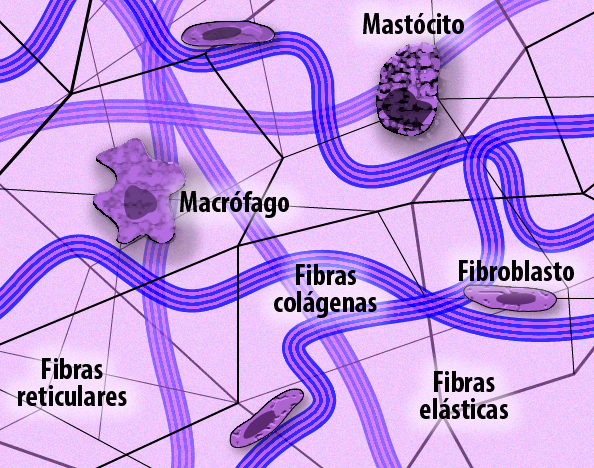
Figura 3
Créditos: Edilson Jacob
Nesse contexto, a fibronectina possui como funções destacadas durante a migração celular e diferenciação de muitos tipos celulares durante a embriogênese, durante a cicatrização de feridas, pois facilita e promove a coagulação sanguínea e facilitam a migração de macrófagos e outras células de defesa do organismo.
