Rafael Pegoraro
Introdução
Os lisossomos são organelas presentes nas células animais e tem papel fundamental no processo de digestão intracelular. Eles atuam devido à presença de enzimas hidrolíticas em seu interior, responsáveis pela degradação de biomoléculas como proteínas, lipídeos, carboidratos e ácidos nucleicos. Essas moléculas podem ser oriundas do meio extracelular e serem adquiridas por meio do processo de fagocitose, ou ainda do próprio meio intracelular, resultantes da renovação metabólica de outras organelas celulares (autofagia).
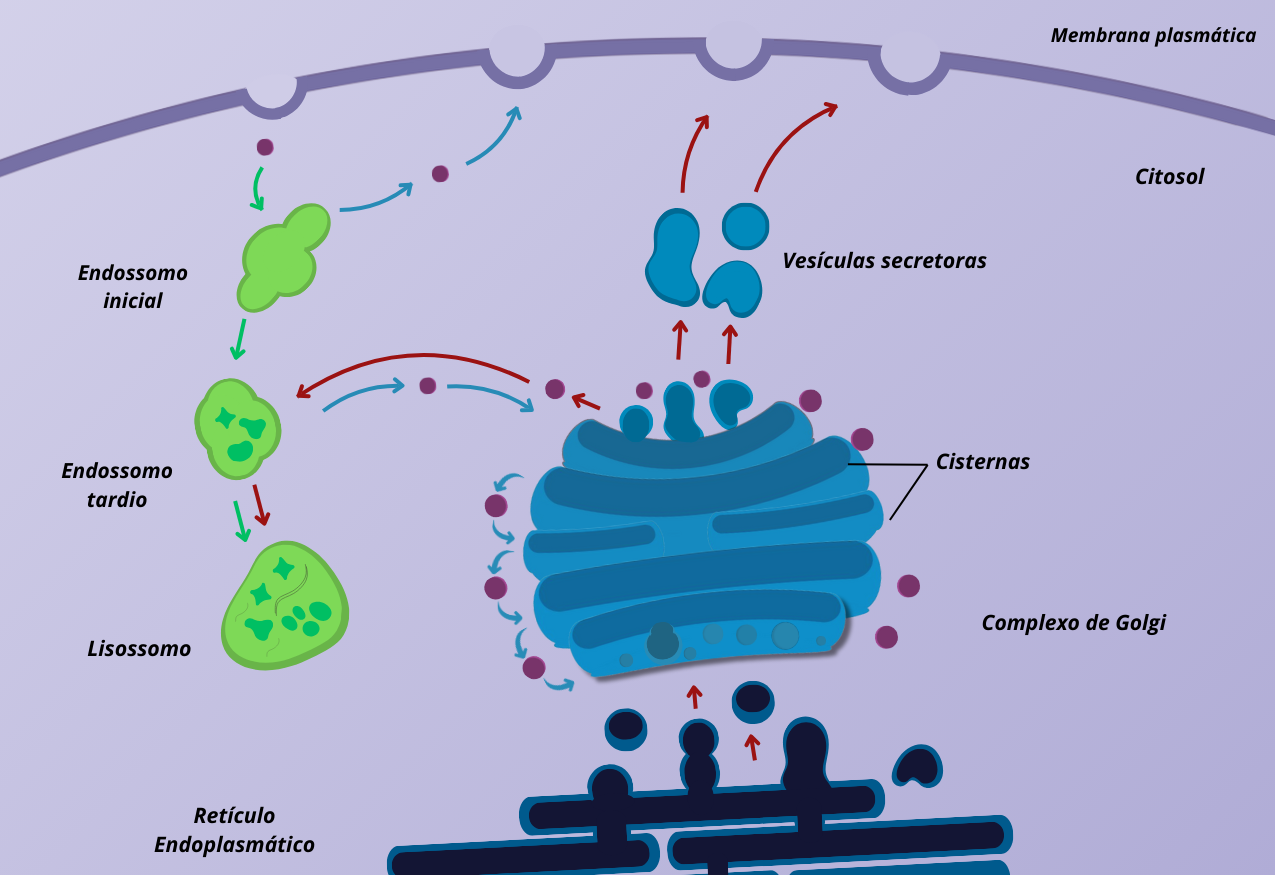
As enzimas lisossomais, assim como proteínas secretadas, são sintetizadas pelos ribossomos presentes no retículo endoplasmático (RE) e processadas no complexo de Golgi, onde sofrem alterações pós traducionais e são encaminhadas para o interior dos lisossomos (Figura 1).
Dessa forma, alterações no processo de síntese ou modificações das enzimas requeridas acarretam no surgimento de patologias conhecidas como “doenças do armazenamento lisossômico”.
Figura 1 – O aparelho de Golgi é frequentemente encontrado próximo do RE nas células. As proteínas movem-se a partir do RE para o Golgi, onde são modificadas, e são então enviadas para vários destinos na célula, incluindo os lisossomos. (Crédito: Isaias Cavalcante de Oliveira)
Definição
As doenças de armazenamento lisossômico compreendem um espectro de patologias onde há o acúmulo de substrato no interior da organela devido a mutações herdadas nos genes que codificam as enzimas necessárias para o processo de digestão intracelular, acarretando numa disfunção metabólica. Os depósitos lisossômicos podem resultar na morte das células afetadas.
Classificação
Atualmente são conhecidas cerca de cinquenta desordens genéticas classificadas como doenças de armazenamento lisossômico, sendo quarenta e sete autossômicas recessivas e três recessivas e ligadas ao cromossomo X (doença de Hunter, doença de Fabry e doença de Danon). Devido ao grande número de deficiências específicas, doenças de armazenamento são geralmente agrupadas bioquimicamente considerando metabólito acumulado. Nesse sentido, essas patologias podem ser divididas em:
– Mucopolissacaridoses (MPS)
– Doenças de depósitos de lipídios
– Mucolipidoses
A tabela 1 lista a maioria das doenças de armazenamento conhecidas, bem como a enzima deficiente envolvida no processo de degradação do substrato.
Tabela 1 –
| Patologia | Enzima deficiente |
|---|---|
| α-manidose | α-manidase |
| Aspartilglicosaminúria | N-aspartilglicosaminidase |
| β-Manosidose | β-Manosidase |
| Cistinose | Cistinosina |
| Doença de Danon | LAMP-2 |
| Doença de Fabry | α-Galactosidase A |
| Doença de Farber | Ceramidase ácida |
| Doença de Gaucher | Glicocerebrosidase e Saposina C |
| Doença de Krabbe | β-Galactosilceramidase |
| Doença de Niemann-Pick | Esfingomielinase ácida |
| Doença de Salla | Sialina |
| Doença de Sandhoff | β-Hexosaminidase subunidade β |
| Doença de Schindler | α-N-Acetilglicosaminidase |
| Doença de Tay-Sachs | β-Hexosaminidase subunidade α |
| Doença de Wolman | Lipase ácida |
| Fucosidose | α-Fucosidase |
| Galactosialidose | Catepsina A |
| Leucodistrofia metacromática | Arilsulfatase A e Saposina B |
| Lipofucinose Ceróide 1 | Palmitoiltioesterase |
| Lipofucinose Ceróide 2 | Tripeptidil peptidase |
| Mucolipidose I | α-Sialidase |
| Mucolipidose II | N-acetilglicosamina-1-fosfotransferase |
| Mucolipidose III | N-acetilglicosamina-1-fosfotransferase |
| Mucolipidose IV | Mucolipina-1 |
| MPS I | α-L-iduronidase |
| MPS II (Doença de Hunter) | Iduronato sulfatase |
| MPS III | Heparano sulfatase, α-N-acetilglicosaminidase, acetyl-Co α-glicosaminida acetiltransferase e N-acetilglicosamina-6-sulfatase |
| MPS IV | galactose-6-sulfatase ou β-galactosidase |
| MPS VI | N-acetilgalactosamina-4-sulfatase |
| MPS VII | β-glicoronidase |
| MPS IX | Hialuronidase |
Mucopolissacaridoses
As MPS’s compreendem o grupo de doenças em que há depósitos de glicosaminoglicanos (GAG’s) no interior dos lisossomos. Essas moléculas são compostas por açúcares (Figura 2) e são capazes de reter grande quantidade de água devido à presença de grupos iônicos.
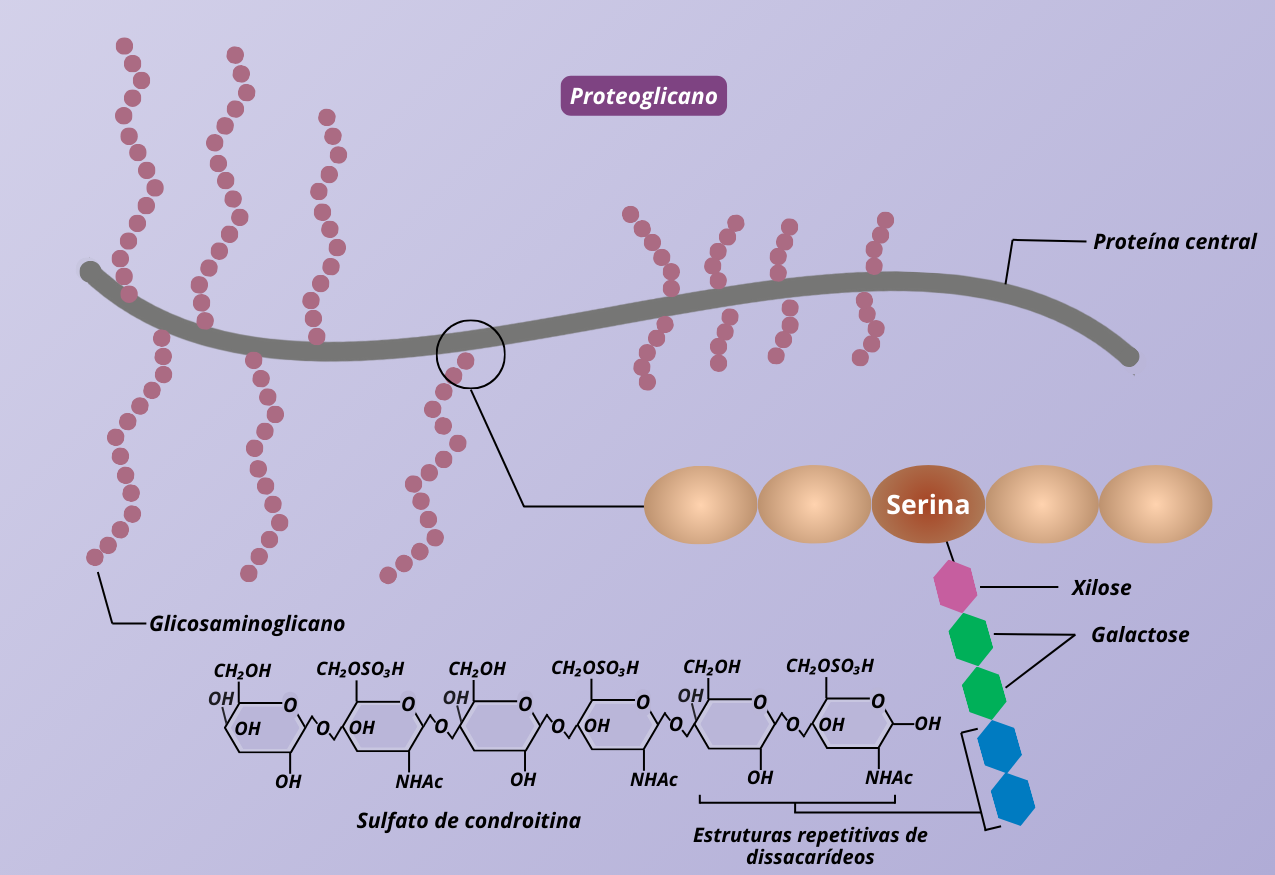
Figura 2 – Os glicosaminoglicanos consistem de uma unidade de repetição de dissacarídeos e existem na forma de proteoglicanos por ligação à resíduos de serina da proteína central. (Crédito: Isaias Cavalcante de Oliveira)
Por isso, os GAG’s são elementos essenciais da matriz extracelular, desempenhando diversas funções no organismo, como a lubrificação entre tecidos, que permite diminuição de atrito e, consequentemente, a movimentação entre eles. São moléculas abundantes nas articulações e tendões do corpo humano, conferindo-lhes elasticidade e resistência a tensões.
Existem sete tipos de MPS’s que variam de acordo com a enzima deficiente e, apesar de diferirem clinicamente, manifestações comuns podem ser estabelecidas como, por exemplo, alterações esqueléticas, enrijecimento capilar, insuficiência respiratória progressiva (causada por obstrução das vias aéreas e apneia do sono), contraturas articulares, alterações faciais, organomegalia, disfunção das válvulas cardíacas e atrasos no desenvolvimento neurológico.
Como em outras doenças genéticas raras, não há cura para as MPS’s. Atualmente o tratamento de reposição enzimática (TRE) é utilizado para pacientes portadores de MPS I, MPS II e MPS VI e consiste na injeção intravenosa da enzima deficiente ou ausente no organismo.
Doenças relacionadas a depósitos de lipídios
Também conhecidas como lipidoses, esse grupo de doenças de armazenamento lisossômico se caracteriza pela deficiência da atuação de enzimas necessárias para o metabolismo de lipídios. O principal grupo de lipidoses existente é conhecido como esfigolipidoses. Outras doenças onde há o acúmulo lipídico incluem: doença de Schindler e doença de Wolman.
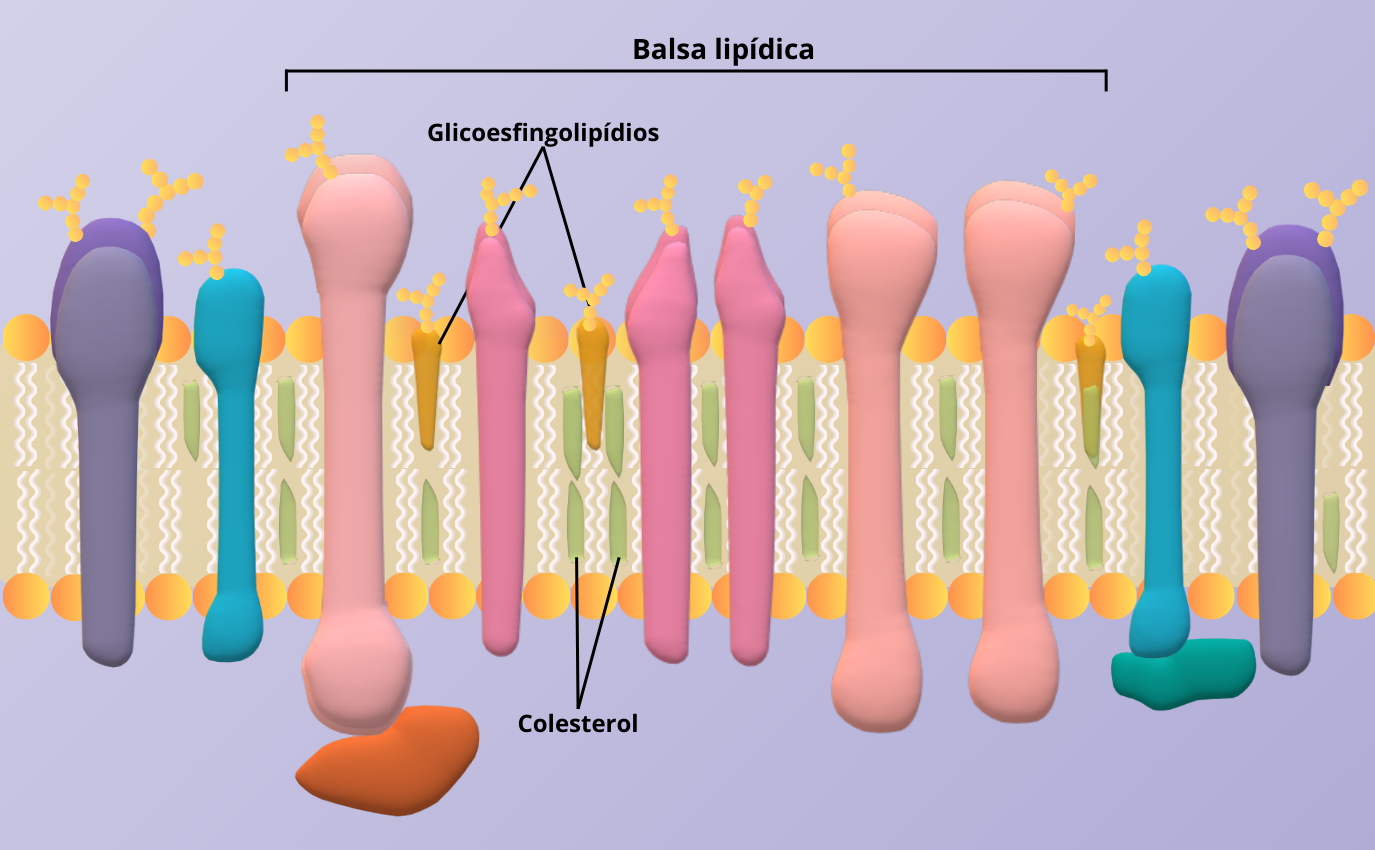
As esfingolipidoses estão relacionadas com desordens no metabolismo de moléculas denominados esfingolipídios. Os esfingolipídios contém esfingosina, um conjunto de amino alcoóis orgânico alifático e são componentes estruturais da membrana celular (Figura 3).
Figura 3 – Os esfingolipídios servem como centros organizadores para a montagem de moléculas de sinalização, influenciando a fluidez da membrana e do tráfico de proteína de membrana. (Crédito: Isaias Cavalcante de Oliveira)
O tipo mais comum desse grupo de doenças é a Doença de Gaucher, onde os sintomas mais comuns são hepatoesplenomegalia e alterações no sistema nervoso central (SNC), já que essas moléculas são componentes fundamentais da bainha de mielina. Doença de Niemann-Pick, de Fabry, de Krabbe, de Tay-Sachs e leucodistrofia metacromática são outros exemplos de patologias que acometem o metabolismo dos esfingolipídios.
O tratamento mais efetivo contra essas doenças também é baseado na reposição enzimática. Além disso, o acompanhamento do volume do baço e do fígado por tomografia computadorizada é necessário nos pacientes com doença de Gaucher.
Mucolipidoses
As mucolipidoses correspondem a desordens que ocorrem durante o processo de modificação enzimática, causando acúmulo de biomoléculas como lipídios, carboidratos e proteínas. Trata-se de uma deficiência na rota de tráfego de proteínas lisossômicas provenientes do RE.
Existem quatro tipo de mucolipidoses (I,II,III e IV) sendo os tipos II e III exemplos clássicos de defeitos de tráfego. Essas doenças ocorrem devido a uma disfunção da enzima N-acetilglicosamina – 1- fosfotransferase, que é responsável pela fosforilação de hidrolases lisossômicas na sua porção N-terminal. Sem a fosforialação, as enzimas lisossômicas não atingem os lisossomos e acabam no meio extracelular.
Apesar de serem originalmente classificadas como mucolipidoses, atualmente o tipo I é classificado como glicoproteinose e o tipo IV como lipidose.
Na mucolipidose tipo II, também conhecida como Doença da célula I, não há a fosforilação dos resíduos de manose para a manose-6-fosfato, que é uma molécula que se liga às enzimas presentes ainda no interior do complexo de Golgi e possibilita seu transporte para o interior dos lisossomos. Sem essa molécula, os lisossomos não recebem as enzimas necessárias para que eles desempenhem sua função. Os sintomas dessa doença são parecidos com as da MPS, mas ocorrem com maior severidade e seus portadores dificilmente ultrapassam os oito anos de idade.
Enquanto isso, a mucolipidose tipo III – também chamada de Síndrome de Hurler-apresenta os mesmos sintomas que a Doença da célula I, mas de forma mais branda e os pacientes conseguem atingir a vida adulta.
A diferença entre as duas patologias reside nas substâncias encontradas no sangue dos pacientes. Portadores da Síndrome de Hurler apresentam somente GAG’s, enquanto pacientes com a Doença da célula I podem apresentar também lipídios e carboidratos no sangue.
O tratamento para esse grupo de doenças consiste somente no controle ou atenuação dos sintomas apresentados.
Estudos e tratamentos
Estudos vêm sendo desenvolvidos com o intuito de se compreender melhor a fisiopatologia de cada doença de armazenamento para que tratamentos específicos possam ser propostos.
Atualmente o tratamento mais utilizado é o TRE. No entanto, ele ainda tem limitações quanto o biodistribuição das enzimas recombinantes a serem repostas além do alto custo.
Um tratamento que se mostra promissor é a utilização de chaperonas químicas, também chamadas de chaperonas farmacológicas, em pacientes portadores de doenças de acúmulos lisossômicos. O tratamento se baseia na utilização de chaperonas, moléculas que auxiliam no enovelamento proteico.
Nas doenças de armazenamento lisossômico há uma disfunção das enzimas sintetizadas ainda no RE que as impedem de chegar aos lisossomos. Isso ocorre pelo fato de o RE possuir um sistema de controle de qualidade para proteínas recém-sintetizadas, que é responsável pela degradação daquelas que não conseguem atingir a estabilidade na conformação tridimensional.
Assim, as chaperonas farmacológicas são desenvolvidas para se ligarem no sítio ativo das enzimas defeituosas com base no preceito de que inibidores competitivos podem auxiliar no enovelamento das enzimas lisossômicas que apresentam mutação, impedindo o reconhecimento pelo sistema de controle de qualidade do RE. Desse modo, as enzimas podem alcançar os lisossomos, passando pelo complexo de Golgi e desempenhar sua função, reduzindo o acúmulo de substratos lisossomais.
Quando atingem os lisossomos, o complexo enzima-chaperona é submetido a um pH menor que aquele do RE. Isso promove a liberação da chaperona e permite a interação enzima-substrato.
Para uso offline:
Para uso em seus estudos quando não é possível conexão com a internet.
Cellzine – Doenças de Armazenamento Lisossômico (Versão resumida em PDF para impressão em uma folha A4)
Referências
– ROBBINS, Stanley L.; COTRAN, Ramzi S.. Patologia: Bases Patológicas das Doenças. Rio de Janeiro: Elsivier Editora Ltda., 2011.
– HOLTZMAN, Eric. Lysosomes. New York: Springer, 1989.
– GREINER-TOLLERSRUD, Ole Kristian; BERG, Thomas. Madame Curie Bioscience Database. Austin: Landes Bioscience, 2000.
– PARENTI, Giancarlo. Treating lysosomal storage diseases with pharmacological chaperones: from concept to clinics. Embo Molecular Medicine, Heidelberg, v. 1, n. 5, p.268-279, ago. 2009.
– B, Winchester; A, Vellodi; E., Young. The molecular basis of lysosomal storage diseases and their treatment. Biochem Soc Trans, London, v. 28, n. 2, p.150-154, fev. 2000.
– LIDOVE, Olivier et al. Effects of enzyme replacement therapy in Fabry disease: a comprehensive review of the medical literature.. Genet Med., Houndmills, v. 12, n. 11, p.668-679, out. 2010.
