Isaias Cavalcante de Oliveira
Introdução
Imagine que você acordou, ligou sua TV e a primeira notícia que ouve é que o sistema de coleta de lixo e reciclagem da sua cidade não vai funcionar por um tempo indeterminado. O que você iria fazer com o lixo que você produziu? Já parou para pensar na importância de um sistema de coleta e tratamento do lixo? Ou então, já pensou como sua casa ficaria se você ficasse muito tempo sem limpar? E, afinal, o que isso tem a ver com os lisossomos?
Os lisossomos funcionam como o “sistema de reciclagem” da célula. Assim como a coleta seletiva transforma resíduos em novos materiais, os lisossomos degradam componentes celulares danificados ou desnecessários, convertendo macromoléculas em blocos menores que podem ser reutilizados. Esse processo é essencial para manter a homeostase celular. Mas, será que fazem apenas isso?
História
Os lisossomos foram descobertos pelo citologista belga Christian René de Duve (1917-2013) na década de 50. Duve, estudava a insulina e seu papel no diabetes mellitus, depois concentrou seus estudos em bioquímica e estruturas celulares. Em 1974 recebeu uma parte do Prêmio Nobel de Fisiologia ou Medicina, destacando-se por sua descoberta dos lisossomos e de outra organela conhecida como peroxissomo. Foi Duve quem criou o termo “autofagia” (do grego auto, “próprio” e fagia, “comer”) referente ao processo de degradação lisossomal de componentes da própria célula, essencial para a homeostase, desenvolvimento e diferenciação celular. Além disso, também estudou e deu nomes aos processos de endocitose e exocitose.
O mesmo prêmio reconheceu Albert Claude (1889-1983), cujos trabalhos ajudaram a elucidar o retículo endoplasmático e o funcionamento da mitocôndria, e George E. Palade (1912-2008), que descobriu e caracterizou os ribossomos. Nesse período, o uso do microscópio eletrônico e equipamentos como a centrífuga de alta velocidade, trouxeram uma grande contribuição no entendimento desses compartimentos celulares e seu funcionamento.
Estrutura e Função
Os lisossomos são delimitadas por membrana capazes de digerir todos os tipos de macromoléculas (proteínas, lipídeos, carboidratos, ácidos nucleicos e outras) e participar da quebra de material extracelular internalizado por endocitose e de componentes citoplasmáticos via autofagia. Para isso, essas organelas contam com cerca de 50 enzimas hidrolíticas em seu lúmen ácido, com destaque para catepsinas. O pH lisossomal (pH ≈ 5) é mantido ácido graças a um bombeamento de prótons (H+), com gasto de energia, do citosol para o interior da organela, gerando um ambiente no qual as enzimas podem funcionar normalmente. Esse bombeamento é realizado por uma bomba de prótons na membrana do lisossomo, pertencente à família das ATPases tipo V. A membrana lisossomal é composta por uma bicamada fosfolipídica típica, sendo altamente glicosilada, fornecendo proteção contra as enzimas contidas no lúmen. Além do meio ácido no interior do lisossomo exercer um papel fundamental para o funcionamento das enzimas, ele também garante proteção para as células. Em que sentido? Caso haja um rompimento da membrana lisossomal, as enzimas liberadas seriam inativadas no citosol (pH ≈ 7,2).
Além da V-ATPase, a membrana contém canais iônicos que regulam Na⁺, K⁺, Ca²⁺ e Cl⁻, proteínas SNARE envolvidas em fusão vesicular, e diversas proteínas integrais altamente glicosiladas. Destacam-se as LAMPs (do inglês, lysosome-associated membrane proteins) e as LIMPs (do inglês, lysosomal integral membrane proteins), que correspondem a grande parte do conteúdo proteico da membrana, embora algumas de suas funções ainda sejam objeto de estudo.
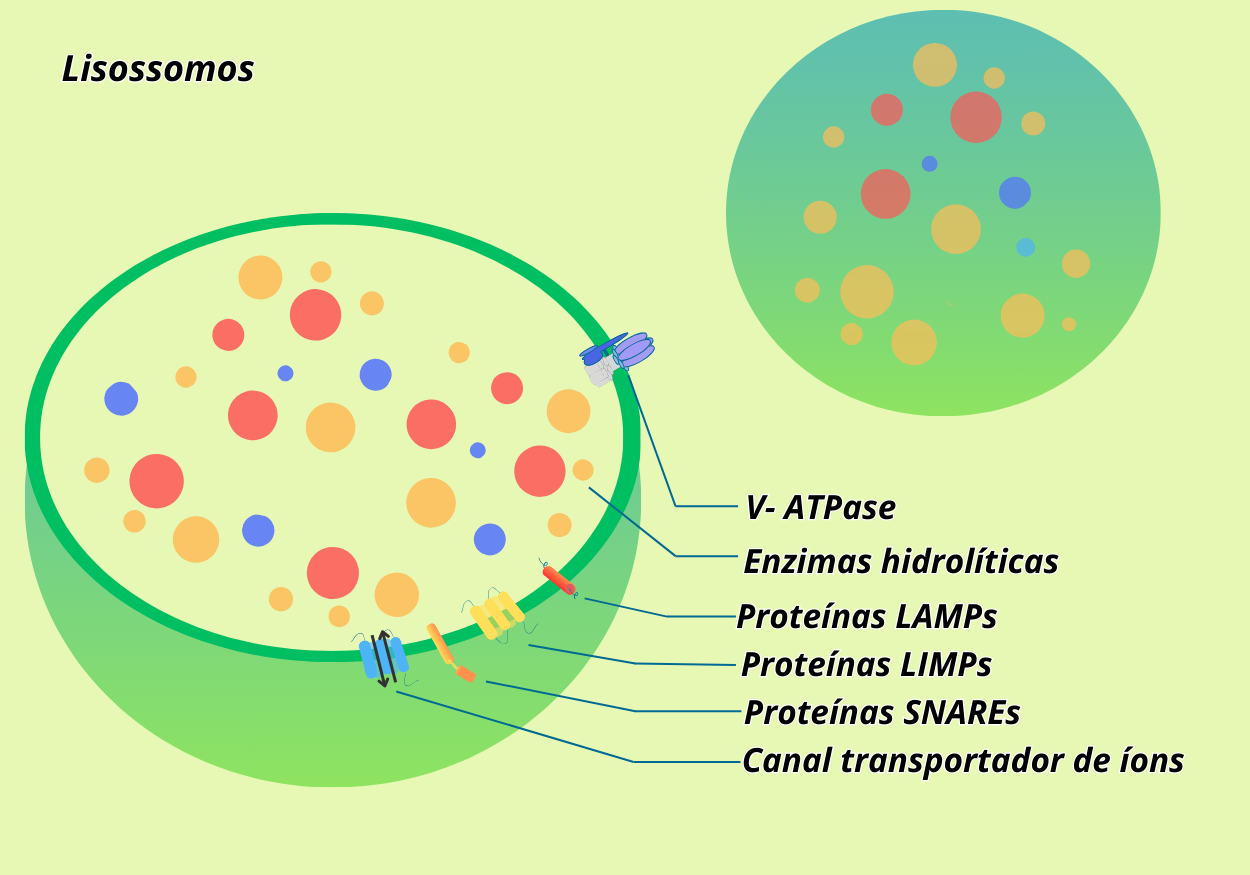
Figura 1 – Estrutura geral de um lisossomo. (Crédito: Isaias Cavalcante de Oliveira)
Endocitose e Formação dos Lisossomos
Em geral, lisossomos são organelas esféricas cujos diâmetros variam de 0,1 µm a 1 µm; no entanto, podem assumir formatos e tamanhos distintos conforme o conteúdo e o tipo celular, o que os torna passíveis de confusão com outras estruturas. Para identificá-los, utilizam-se anticorpos específicos e testes histoquímicos que evidenciam hidrolases ácidas (por exemplo, a fosfatase ácida, marcada em cortes histológicos).
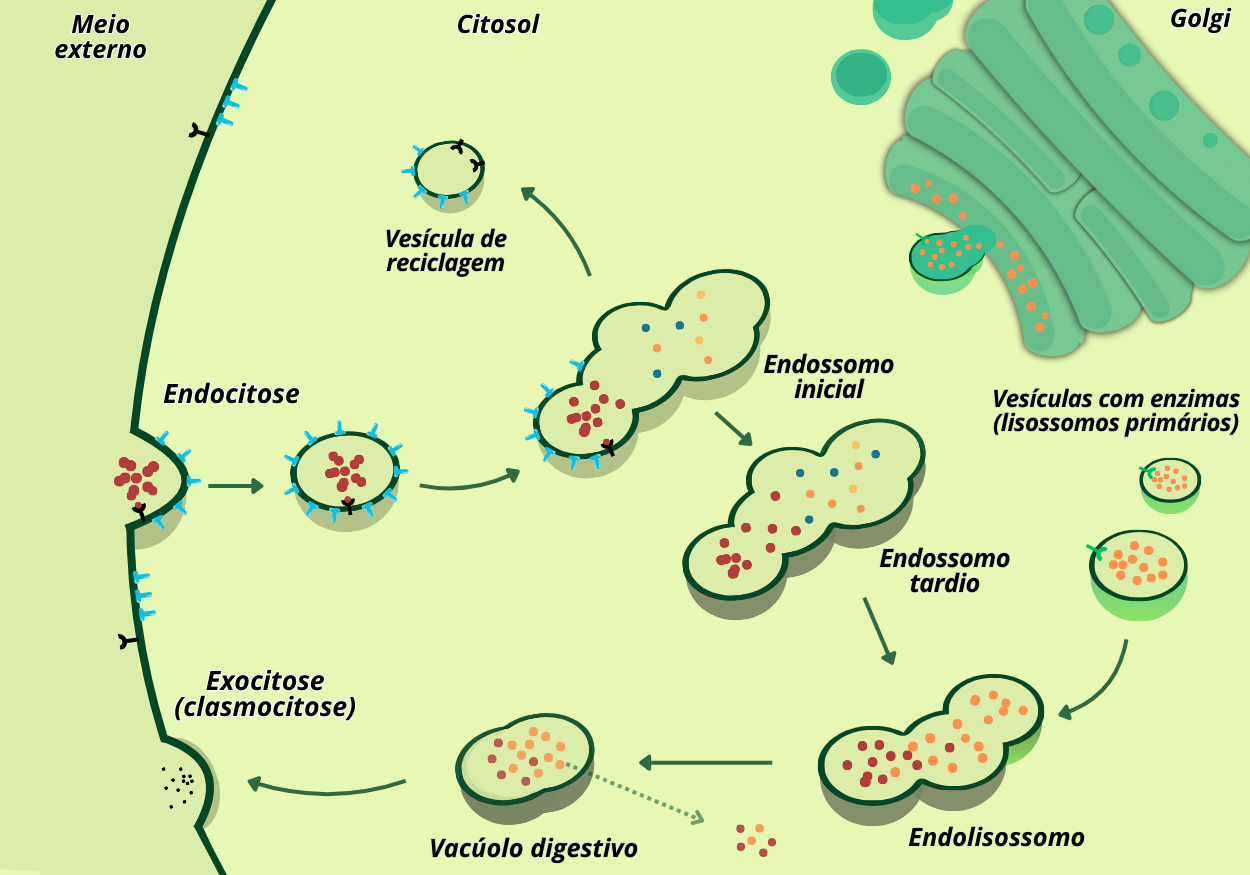
Segundo a maioria dos autores, os lisossomos se originam quando vesículas endocíticas (endossomos), contendo material extracelular, fundem-se a vesículas de transporte oriundas da rede trans-Golgi, carregadas de enzimas recém-processadas. A formação, portanto, integra duas rotas:
-
Via secretora — proteínas lisossomais são sintetizadas no retículo endoplasmático (RE), glicosiladas e empacotadas no complexo de Golgi, de onde brotam vesículas ricas em hidrolases;
-
Via endocítica — moléculas extracelulares são capturadas na superfície celular por endocitose.
A fusão entre lisossomos, endossomos, autofagossomos e até a membrana plasmática requer liberação local de Ca²⁺, que atua como sinal. Na endocitose mediada por receptor, invaginações da membrana plasmática formam vesículas revestidas por clatrina; essas vesículas perdem o revestimento e se fundem aos endossomos iniciais. Componentes de membrana (receptores, proteínas de revestimento e de fusão) são reciclados de volta à superfície celular.
À medida que amadurecem, os endossomos iniciais tornam-se endossomos tardios: recebem prótons por ação da V-ATPase, diminuindo o pH, e incorporam as hidrolases vindas da rede trans-Golgi. Uma vez plenamente acidificados e carregados de enzimas, convertem-se em lisossomos funcionais.
Figura 2 – Endocitose e formação dos lisossomos. (Crédito: Isaias Cavalcante de Oliveira)
As enzimas hidrolíticas conseguem chegar ao destino correto porque durante o seu processamento no complexo de Golgi elas são fosforiladas em seus resíduos de manose, formando o marcador manose-6-fosfato (M6P). Esse sinal é reconhecido por receptores de M6P na rede trans-Golgi, que segregam as enzimas em vesículas revestidas por clatrina com destino aos endossomos tardios. Após a fusão dessas vesículas com o endossomo, a baixa acidez do lúmen provoca a dissociação das hidrolases dos receptores; estes e as proteínas de revestimento são reciclados de volta ao Golgi, enquanto as enzimas permanecem no compartimento, que então passa a funcionar como lisossomo.
Mas o que acontece quando alguma dessas hidrolases está ausente ou defeituosa? Nessa situação surgem as doenças de armazenamento lisossômico, nas quais substratos parcialmente degradados se acumulam dentro da célula, comprometendo sua função e levando a manifestações clínicas graves.
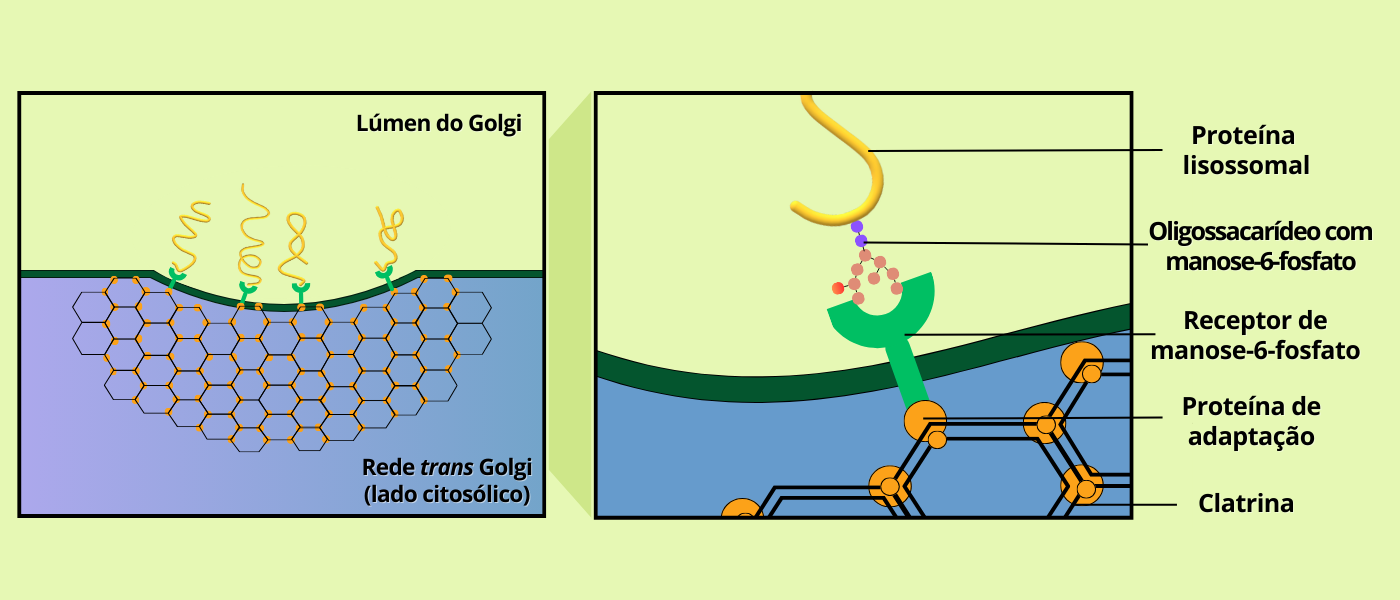
Figura 3 – Brotamento de vesículas revestidas por clatrina da rede Trans Golgi. O quadro da direita mostra as enzimas lisossomais sendo reconhecidas pelos receptores de manose na membrana lisossomal. Baseado em COOPER & HAUSMAN, 2007. (Crédito: Isaias Cavalcante de Oliveira)
Fagocitose
Além da endocitose mediada por receptor, outras rotas degradativas convergem para os lisossomos. Na fagocitose, partículas grandes (como células senescentes, detritos celulares, vírus ou bactérias inteiras) são englobadas por expansões da membrana plasmática que formam um fagossomo. Esse processo ocorre em células especializadas, como macrófagos, neutrófilos, células dendríticas e osteoclastos.
A internalização exige o reconhecimento entre receptores de superfície e ligantes presentes na partícula. No caso de patógenos, por exemplo, a fagocitose pode ser do tipo “opsonizada”, onde os patógenos são previamente marcados por anticorpos ou proteínas do sistema complemento, ou pode ser “não opsonizada”, no caso dos patógenos serem diretamente reconhecidos e fagocitados. Após a formação, o fagossomo funde-se a um lisossomo, originando um fagolisossomo, onde o conteúdo é degradado. Esses fagolisossomos costumam ser volumosos e heterogêneos, refletindo a natureza variada do material ingerido.
Quando a célula internaliza pequenas quantidades de fluido e solutos, o processo recebe o nome de pinocitose. Ela pode ocorrer de maneira não seletiva, incorporando porções de meio extracelular ao acaso, ou seletiva, mediada por receptores que reconhecem moléculas específicas na superfície.
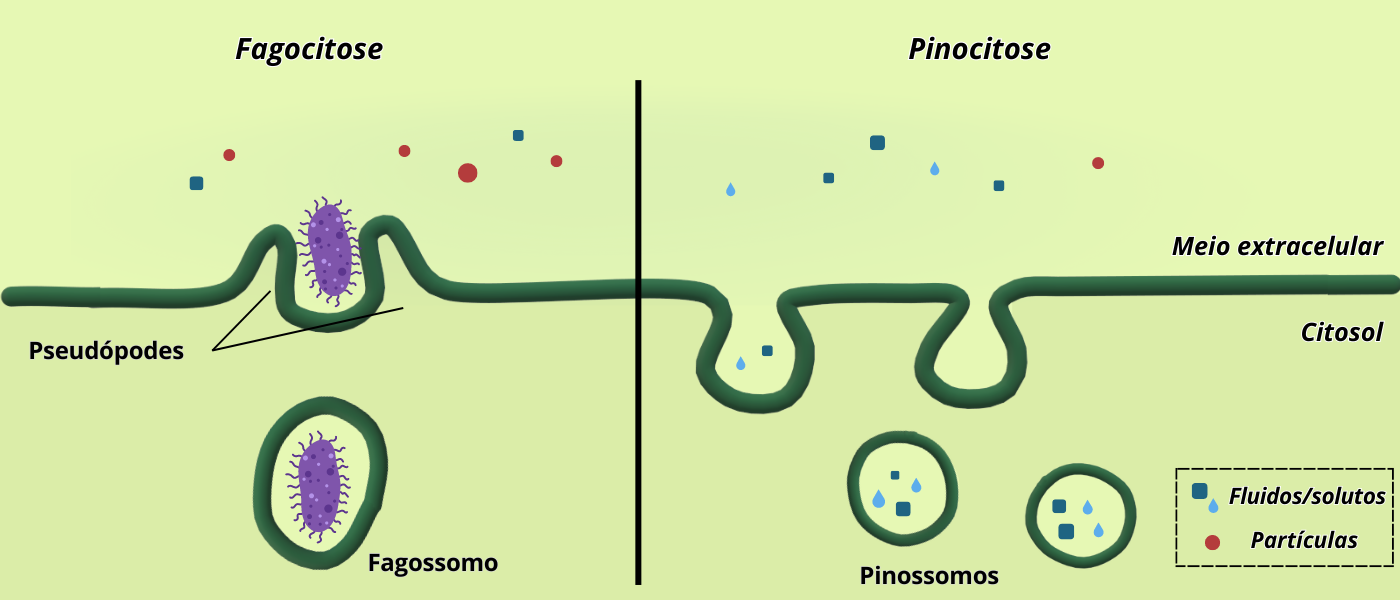
Figura 4 – Fagocitose e pinocitose. Baseado em: MOREIRA, C., (2015). (Crédito: Isaias Cavalcante de Oliveira)
Autofagia: como funciona?
Na autofagia (também chamada de macroautofagia), componentes citoplasmáticos (organelas danificadas, proteínas agregadas ou porções de citosol) são degradados no interior dos lisossomos. A autofagia é essencial durante o crescimento normal da célula, ajudando a reestruturar células em diferenciação. Pense em seu desenvolvimento, em como você cresceu. Este processo biológico é indispensável ao crescimento e à diferenciação celular, pois viabiliza a remodelação de organelas e a reciclagem de biomoléculas. Certamente seu corpo passou por diversas transformações e remodelações teciduais que estão muito relacionadas ao processo autofágico. Também é importante nas respostas adaptativas a estresses (como fome e infecção) e processos inflamatórios. Caso o processo de autofagia de uma célula não funcione, é esperado que a célula tenha problemas em combater e degradar microrganismos, substâncias tóxicas e proteínas mal enoveladas, contribuindo para o surgimento de doenças, desde distúrbios infecciosos até degeneração celular e câncer.
O processo autofágico se inicia quando sinalizadores químicos atuam transmitindo informações sobre a condição metabólica da célula e “recrutando” às estruturas envolvidas na autofagia. Após isso, há uma fusão de uma série de pequenas vesículas (grande parte derivadas do RE) ao redor da carga citoplasmática (uma organela, por exemplo), formando uma estrutura de dupla membrana chamada fagóforo, que se acaba se fechando em torno da porção citoplasmática originando um autofagossomo. É característico dessas vesículas a presença de proteínas Atg (Autophagy-related protein), especialmente a Atg9, uma proteína transmembranar que se concentra durante a formação do autofagossomo e tem sua localização principal em pequenas vesículas derivadas da rede trans-Golgi. Depois da montagem, a Atg9 é removida por uma via de reciclagem vesicular. Note que o autofagossomo formado tem membrana dupla. Ele então se funde a um lisossomo, num processo mediado pelas proteínas SNAREs, onde a membrana interna e o conteúdo é digerido. Quando os componentes citosólicos são incorporados diretamente pelos lisossomos, através de invaginações da membrana lisossomal, dá-se o nome de microautofagia. Por fim, há um tipo de autofagia mediada pelas chaperonas, proteínas que auxiliam o enovelamento correto de outras proteínas. Nesse caso, as proteínas que vão ser degradadas têm motivos (sequências conservadas) específicos, reconhecidas pelas chaperonas, que as transportam até o lisossomo para degradação.
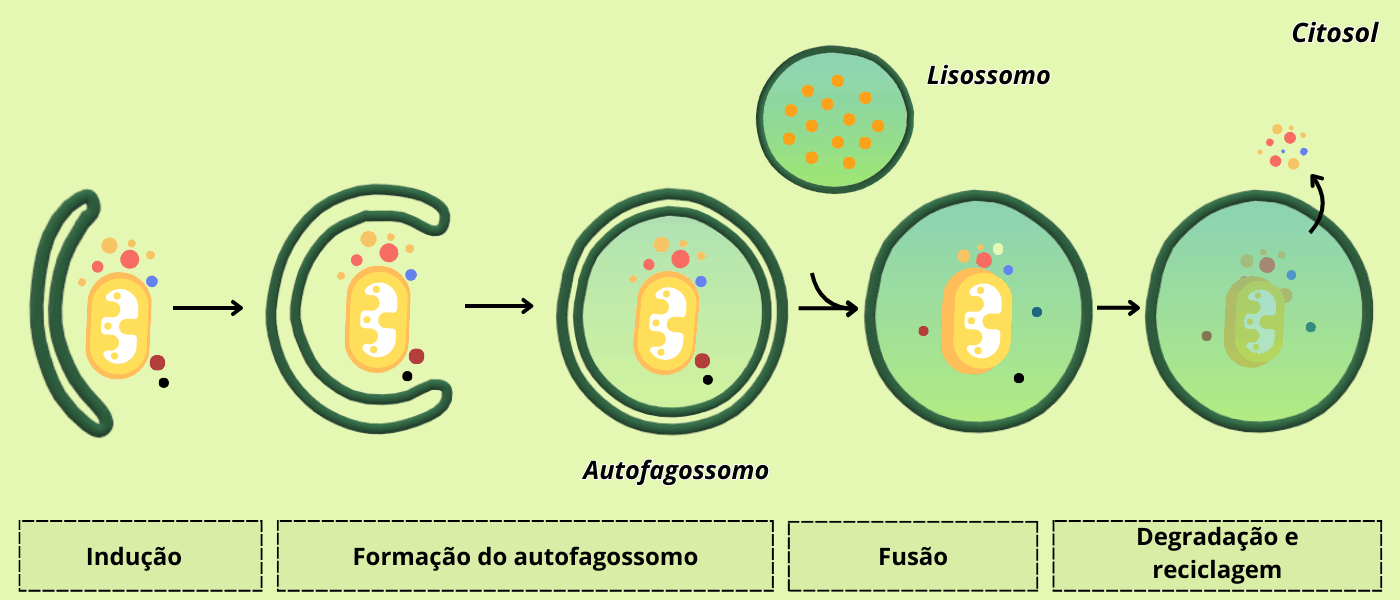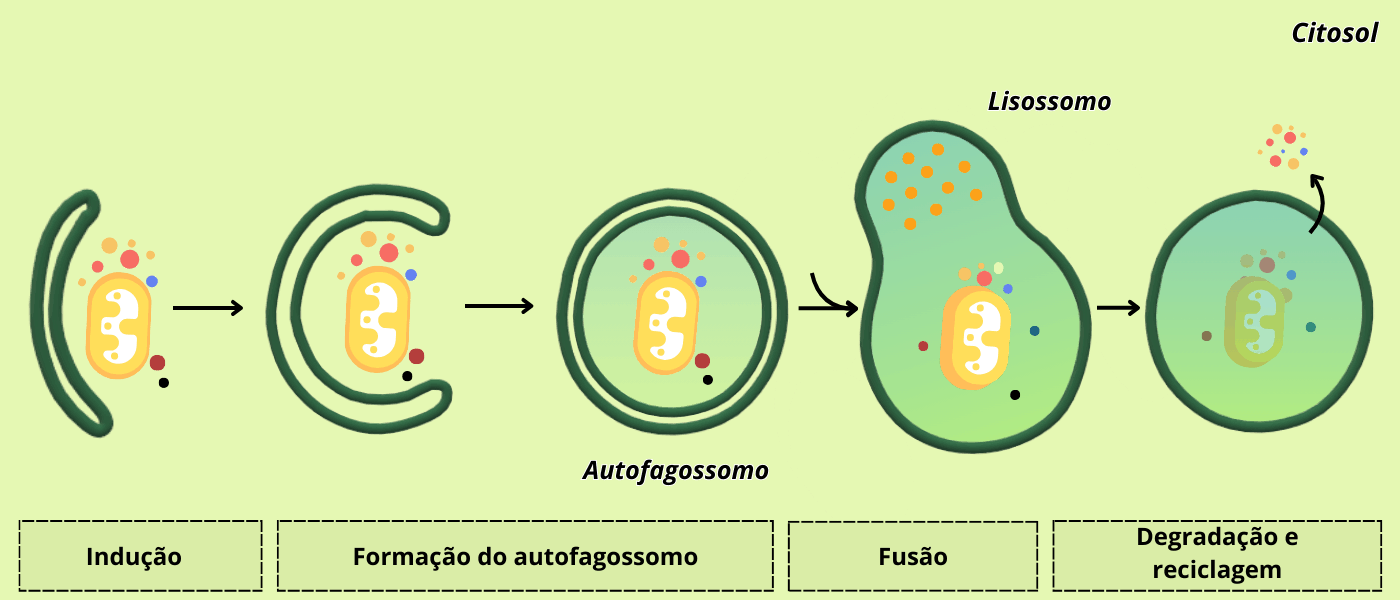
Figura 5 – Formação do autofagossomo. Baseado em FLORES, 2020 – Escola Educação. (Crédito: Isaias Cavalcante de Oliveira)
A biologia celular e molecular da sinalização: papel do mTOR e AMPK
Agora, vamos conhecer melhor uma clássica via de sinalização celular, bem conhecida por seu papel na autofagia, que inclui o mTORC1 (do inglês, mammalian target of rapamycin complex) um complexo quinase de serina/treonina importante na biogênese, distribuição e atividade dos lisossomos e que funciona como uma proteína quinase (há também o mTORC2, mas não será o foco aqui) e a AMPK 2 (do inglês AMP-activated protein kinase) também uma proteína quinase, ativada por AMP, que atua praticamente de forma antagônica ao mTORC e está envolvida na estimulação da oxidação de ácidos graxos, absorção de glicose, inibição da síntese de lipídios e colesterol e outros processos que, em conjunto, restauram o nível celular de ATP e ativam a autofagia.
Antes de te explicar, assista a animação abaixo primeiro, é bem rápida. Pronto? Agora, vamos entender como acontece.
Animação 1 – Autofagia: mTORC1 e AMPK. (Crédito: Isaias Cavalcante de Oliveira)
Quando há abundância de nutrientes (especialmente aminoácidos como arginina e leucina), o complexo mTORC1 é recrutado para a superfície lisossomal, onde é ativado pela Rheb (do inglês, Ras homolog enriched in brain), uma pequena GTPase que se encontra em sua forma ligada a GTP. Também, é necessário a presença de um grupo de proteínas Rag (do inglês, Ras-related GTP-binding protein), que funcionam como heterodímeros nos quais o complexo ativo consiste em RagA ou B ligado a GTP associados a RagC ou D ligado a difosfato de guanosina (GDP). Mas, não basta ter apenas as Rag GTPases ativas! Um complexo de proteína pentamérica ancora as Rag GTPases aos lisossomos, o Ragulator (que nome trivial, não?).
A atividade da Rheb é regulada por um outro complexo conhecido como complexo da esclerose tuberosa (TSC). Assim, na presença de fatores de crescimento (como IGF1, EGF, NGF) ou insulina, o TSC libera sua atividade inibitória sobre Rheb, permitindo assim a ativação do mTORC1. Após sua ativação o mTORC1 fosforila várias proteínas-chave que controlam a iniciação da autofagia, suprimindo a formação de autofagossomos e diminuindo (ou inibindo) a autofagia. Contrariamente, a fosforilação dessas mesmas proteínas em resíduos alternativos pela AMPK (ativada por alta razão AMP/ATP durante jejum ou estresse celular) ativa a montagem do autofagossomo em resposta à fome e ao estresse celular. Portanto, podemos observar que alterações nos níveis de nutrientes e também de fatores de crescimento (entre outros) afetam diretamente a maquinaria da autofagia. Tais mudanças levam a uma resposta adaptativa pelas células, onde os produtos da digestão do autolisossomo são reciclados de volta ao citoplasma ou a outras organelas e a homeostase celular é regulada. Legal, não?
É interessante notar que uma série de genes são ativados e inativados nesse processo. Por exemplo, durante o período de fome e inativação de mTORC1, um importante fator de transcrição, conhecido como TFEB (transcription factor EB), é rapidamente translocado para o núcleo, levando a expressão de genes de proteínas lisossomais e de autofagia, como genes de proteínas de fusão de membranas, formação de autofagossomos e outros. O TFEB quando fosforilado pelo mTORC1 fica retido no citoplasma. Muitos desses genes foram agrupados em uma única família, a ATG (autophagy related, relacionados a autofagia), já comentada aqui. Esse é um resumo simplificado e ainda estamos descobrindo muitas coisas novas sobre sinalização e regulação lisossomal.
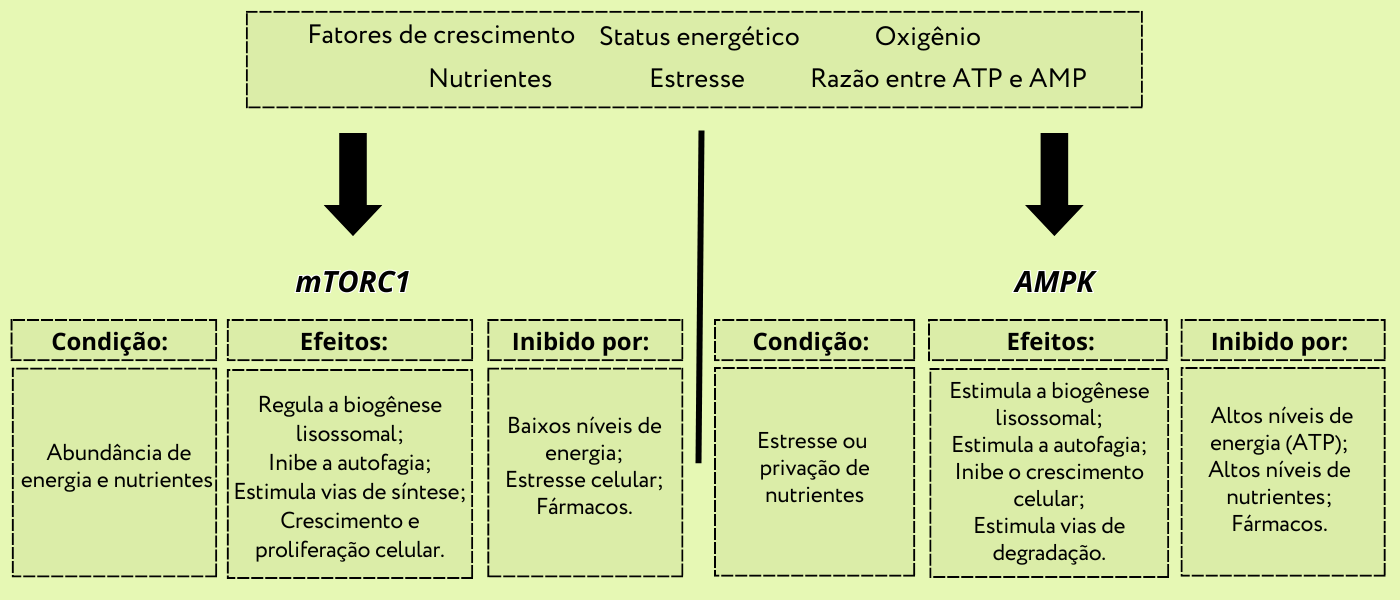
Figura 6 – Resumo da sinalização celular. (Crédito: Isaias Cavalcante de Oliveira)
Contribuições práticas
Para que saber tudo isso? Simples. Essas vias são importantes em vários contextos, como no exercício físico, onde a AMPK é ativada para ajudar na recuperação energética e adaptações musculares. Além disso, a sinalização da AMPK pode influenciar a biogênese mitocondrial e a gliconeogênese e o mTORC1 no reparo do DNA, síntese de proteínas, e angiogênese. Portanto, entender essas vias pode ajudar a elucidar mecanismos de doenças metabólicas, como diabetes e obesidade, ou degenerativas e contribuir para o desenvolvimento de estratégias terapêuticas para tais condições. Sabendo disso, você pode conhecer melhor aspectos fisiológicos, ser mais preciso no diagnóstico de seus pacientes e se aprofundar na fisiologia do exercício, caso trabalhe na área da saúde, por exemplo.
Lisossomos: apenas em células animais?
De modo geral, acredita-se que os lisossomos são encontrados exclusivamente em células eucarióticas de animais. Nos vegetais, muitos fungos e alguns protistas, uma outra organela pode cumprir seu papel: o vacúolo. Os vacúolos são estruturas com formato mais ou menos esférico ou oval, preenchidos com fluidos e que podem exercer diferentes funções, dependendo de seu conteúdo interno. Podem armazenar uma diversidade de substâncias (vacúolos de armazenamento), como açúcares, proteínas, compostos fenólicos e pigmentos. Já os vacúolos digestivos, assim como os lisossomos contêm enzimas digestivas e degradam muitos componentes celulares. Essas organelas podem também auxiliar no controle osmótico, manutenção do pH da célula, pigmentação da planta e até mesmo na defesa contra patógenos e herbívoros. Certos protozoários, como os paramécios, têm um vacúolo especial: o vacúolo pulsátil (contrátil). Sua função é eliminar o excesso de água que entra nesses organismos por osmose ou que acaba sendo absorvida junto do alimento.
Em síntese, embora os lisossomos sejam característicos de células animais, vacúolos e outras vesículas líticas exercem funções equivalentes em diversos grupos eucarióticos, assegurando a digestão intracelular e a homeostase.
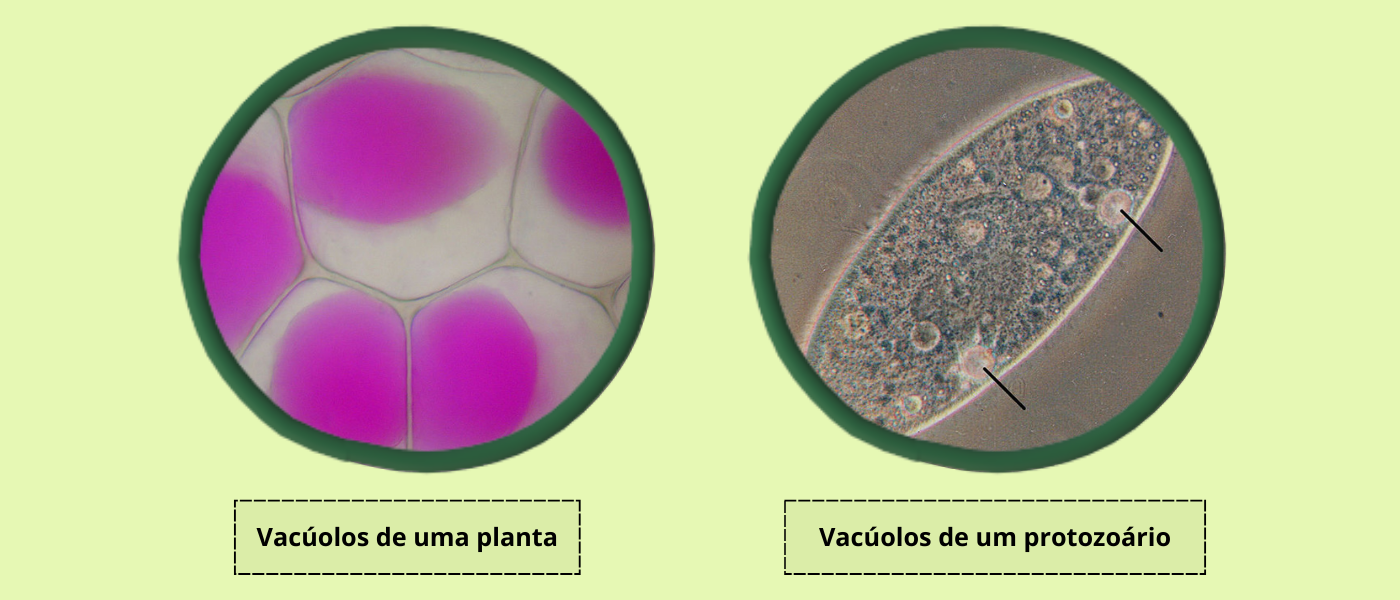
Figura 7 – Vacúolos. À esquerda é possível observar as células da epiderme de Rhoeo discolor (Tradescantia), conhecida como “abacaxi-roxo” após sofrerem plasmólise (perda de água). Os vacúolos (em rosa) se encolheram. Campo de visão: ~450 µm. Adaptada de https://commons.wikimedia.org/wiki/File:Rhoeo_Discolor_-_Plasmolysis.jpg sobre licença CC BY-SA 3.0 | Autor: Mnolf. À direita é possível ver os vacúolos pulsáteis de Paramecium aurelia, um protozoário ciliado. Adaptada de https://commons.wikimedia.org/wiki/File:Paramecium_contractile_vacuoles.jpg sobre licença CC BY-SA 3.0 | Autor: Olaf Studt. (Crédito: Isaias Cavalcante de Oliveira)
Cheguei nos lisossomos: é o fim da via?
Na maioria dos casos, os lisossomos digerem o conteúdo que chega até eles e os produtos finais dessa digestão (aminoácidos, monossacarídeos, nucleotídeos) são transportados ativa ou passivamente por proteínas integrais da membrana lisossomal para o citoplasma, podendo ser aproveitados pelas células em reações de síntese. Contudo, esse não é o único caminho possível. Muitos materiais também sofrem exocitose, sendo eliminados pelas células a partir dos lisossomos. Um exemplo interessante ocorre nos melanócitos da pele, células que produzem pigmentos (eumelanina, feomelanina) e os armazenam em seus lisossomos, determinando nossa cor de pele, cabelo, etc. Os melanossomos liberam o seu conteúdo no espaço extracelular da epiderme por exocitose. O pigmento é então capturado por queratinócitos, levando à pigmentação normal da célula. Falhas nesse processo, ocasionadas por mutações genéticas, por exemplo, podem levar a diferentes graus de hipopigmentação, como no albinismo. Ademais, pesquisas recentes indicam que os lisossomos podem funcionar como um local de armazenamento celular de diversas substâncias.
Dinâmicos e reguladores
Se você chegou até aqui, deve estar interessado em saber mais sobre essa organela tão incrível! Como já vimos, os lisossomos fazem muito mais que apenas reciclar nutrientes para as células. Os lisossomos também têm a capacidade de mudar frequentemente sua direção de movimento. Isso acontece com auxílio dos microtúbulos e proteínas motoras, e podem alternar entre o movimento direcionado para a extremidade positiva, mediado por várias cinesinas (transporte anterógrado – da região perinuclear em direção à periferia da célula) e o movimento direcionado para a extremidade negativa, mediado pela dineína (transporte retrógrado – da periferia da célula em direção à região perinuclear). Estudos recentes indicam que não se trata de um movimento “aleatório” como se pensava. Na presença de aminoácidos e fatores de crescimento, os lisossomos tendem a localizar-se mais próximos da membrana plasmática. Essa localização pode ter várias funções importantes, como o reparo da membrana plasmática e secreção de conteúdo lisossomal para o espaço extracelular. Também há indícios de que o posicionamento lisossômico influencia na atividade dos complexos mTORC, regulando a proximidade da sua quinase aos sinais em seu entorno.
Por outro lado, acredita-se que o transporte retrógrado de lisossomos para a área ao redor do núcleo sob condições de fome é essencial para facilitar sua fusão com autofagossomos. Concluímos dizendo que, os lisossomos não atuam de forma isolada, podendo fazer contato com outras organelas, sem necessariamente se fusionar (contato não fusogênico), como o complexo de Golgi, retículo endoplasmático, melanossomos, peroxissomos e mitocôndrias. Temos muito o que descobrir!
Referências
ALBERTS, B. et al. 2017. Biologia Molecular da Célula. 6ª ed. Artmed
ALLEMAILEM, K. S. et al. Novel Approaches of Dysregulating Lysosome Functions in Cancer Cells by Specific Drugs and Its Nanoformulations: A Smart Approach of Modern Therapeutics. International Journal of Nanomedicine, v. Volume 16, p. 5065–5098, jul. 2021. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8324981/
AMARAL, O. et al. The Biology of Lysosomes: From Order to Disorder. Biomedicines, v. 11, n. 1, p. 213, 1 jan. 2023. Disponível em: https://www.mdpi.com/2227-9059/11/1/213
BALLABIO, A.; BONIFACINO, J. S. Lysosomes as dynamic regulators of cell and organismal homeostasis. Nature Reviews Molecular Cell Biology, v. 21, n. 2, p. 101–118, 25 nov. 2019. Disponível em: https://www.nature.com/articles/s41580-019-0185-4
BLOBEL, G. Christian de Duve (1917–2013). Nature, v. 498, n. 7454, p. 300–300, 1 jun. 2013. Disponível em: https://doi.org/10.1038/498300a
CARROLL, B.; DUNLOP, E. A. The lysosome: a crucial hub for AMPK and mTORC1 signalling. Biochemical Journal, v. 474, n. 9, p. 1453–1466, 13 abr. 2017. Disponível em: https://pubmed.ncbi.nlm.nih.gov/28408430/
COOPER, G. M.; HAUSMAN, R. E. A Célula, Uma Abordagem Molecular. 3 ª ed. Porto Alegre: Artmed, 2007.
ESKELINEN, E.-L.; TANAKA, Y.; SAFTIG, P. At the acidic edge: emerging functions for lysosomal membrane proteins. Trends in Cell Biology, v. 13, n. 3, p. 137–145, mar. 2003. Disponível em: https://www.sciencedirect.com/science/article/abs/pii/S0962892403000059
FLORES, DENISELE. Autofagia. Escola Educação. 29 mai 2020. Disponível em: https://escolaeducacao.com.br/autofagia/.
KLIONSKY, D. J. Look people, “Atg” is an abbreviation for “autophagy-related.” That’s it.. Autophagy, v. 8, n. 9, p. 1281–1282, 14 set. 2012. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3442874/
MOREIRA, C. Fagocitose. Revista de Ciência Elementar, v. 3, n. 4, 2015. Disponível em: https://rce.casadasciencias.org/rceapp/art/2015/256/
PERERA, R. M.; ZONCU, R. The Lysosome as a Regulatory Hub. Annual Review of Cell and Developmental Biology, v. 32, n. 1, p. 223–253, 6 out. 2016. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9345128/
PUERTOLLANO, R. mTOR and lysosome regulation. F1000 Prime Reports, v. 6, 8 jul. 2014. Disponível em: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4108950/
TAN, A. et al. Past, present, and future perspectives of transcription factor EB (TFEB): mechanisms of regulation and association with disease. Cell Death and Differentiation, v. 29, n. 8, p. 1433–1449, 1 ago. 2022. Disponível em: https://www.nature.com/articles/s41418-022-01028-6
WIKIPEDIA. Ragulator-Rag complex. Disponível em: https://en.wikipedia.org/wiki/Ragulator-Rag_complex
WINCHESTER, B. G. Lysosomal membrane proteins. European Journal of Paediatric Neurology, v. 5, p. 11–19, jan. 2001. Disponível em: https://doi.org/10.1053/ejpn.2000.0428
