Isaias Cavalcante de Oliveira
Introdução
O núcleo é um compartimento intracelular delimitado por uma dupla membrana (interna e externa) denominada envelope nuclear (ou carioteca) que apresenta ao longo de sua extensão inúmeros poros que controlam a entrada e saída de substâncias entre o núcleo e o citoplasma, constituindo a sede do controle celular. Para muitos autores, o envelope é constituído pela dupla membrana, os poros e a lâmina nuclear. Em seu interior abriga a maior parte do material genético da célula, o DNA. Em microscopia geralmente possui um formato esférico-ovoide ou alongado, sendo que o tamanho e a forma do núcleo variam conforme a morfologia da célula. O DNA se apresenta associado a diversas proteínas (histonas principalmente, além de proteínas não-histonas) constituindo a cromatina, um complexo que protege e empacota essa molécula e ainda permite diversos níveis de compactação aos cromossomos.
A presença de um núcleo celular organizado (delimitado pela carioteca) permite que haja uma separação espacial e temporal entre os eventos que ocorrem no núcleo e no citoplasma como a síntese de DNA (replicação), transcrição e processamento do RNA ocorrendo no núcleo e a tradução (estágio final da expressão gênica) ocorrendo no citoplasma. Nas células desprovidas de núcleo, como nas bactérias e arqueias, o material genético fica “livre” no citoplasma (nucleóide), organizado em uma ou mais moléculas de DNA circulares, por vezes associadas a algumas proteínas, permitindo que a transcrição e tradução possam ocorrer acopladas. Desse modo, é possível organizar os organismos vivos em dois grupos com base na estrutura celular: os eucariotos (eu, “verdadeiro”, e karyon, “centro” ou “núcleo”) e os procariotos (pro, “antes”, e karyon, “centro” / “núcleo”). Vale lembrar que o núcleo não está presente em todas as células eucarióticas. As nossas hemácias (eritrócitos), por exemplo, não possuem núcleo, pois ele é eliminado durante o processo de produção e diferenciação celular (hemocitopoese) que gera tais células a partir de células pluripotentes da medula óssea. Isso é relevante, pois as hemácias ganham mais flexibilidade e o espaço ocupado pelo núcleo é “usado” para abrigar mais moléculas de hemoglobina e, portanto, mais oxigênio. Em contrapartida, algumas células, como os osteoclastos – importantes no processo de reabsorção e remodelagem óssea – são multinucleadas.
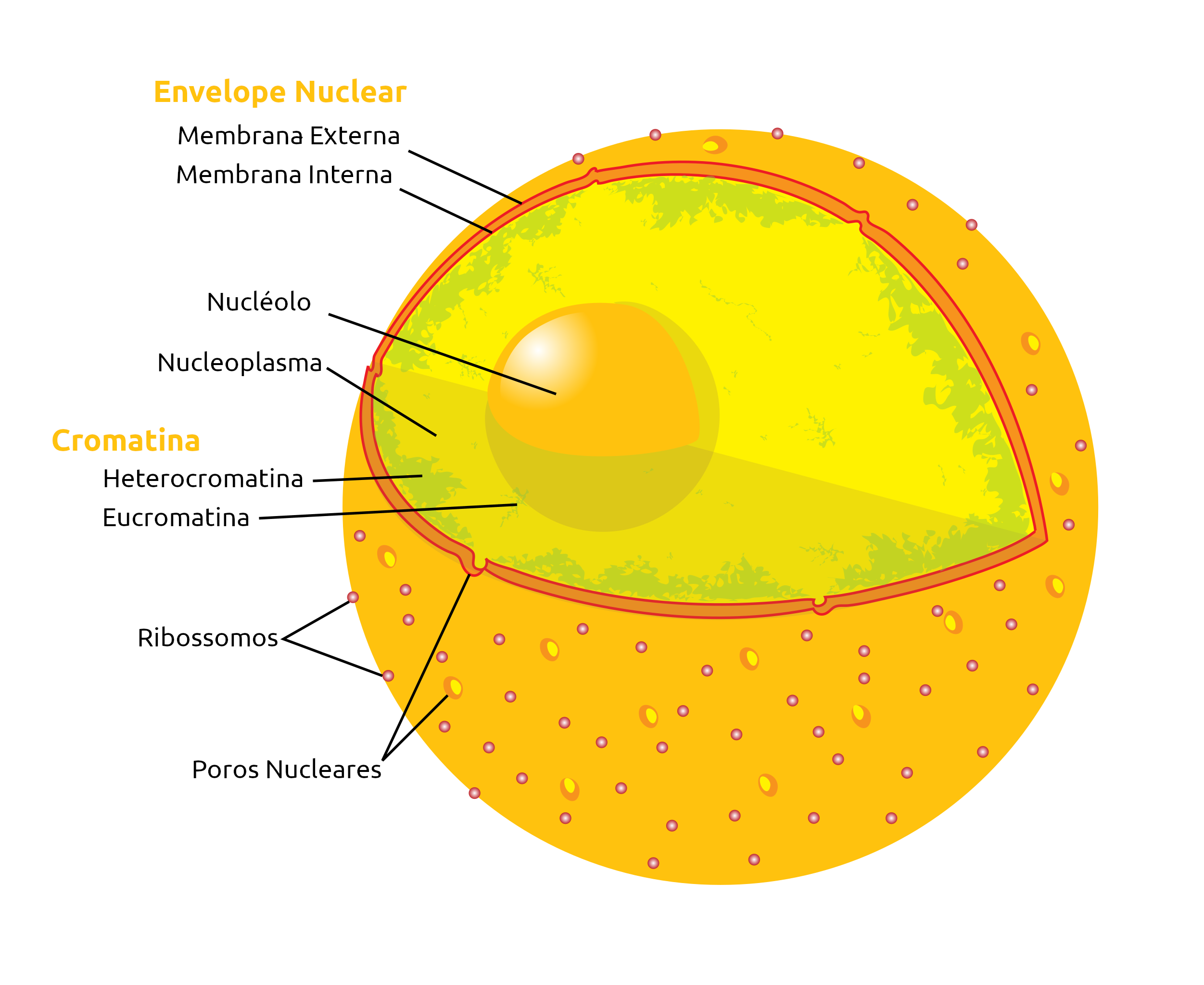
Figura 1 – Diagrama de um núcleo de célula eucariota. Modificado de Mariana Ruiz LadyofHats, Public Domain, https://commons.wikimedia.org/w/index.php?curid=736389
O Envelope Nuclear
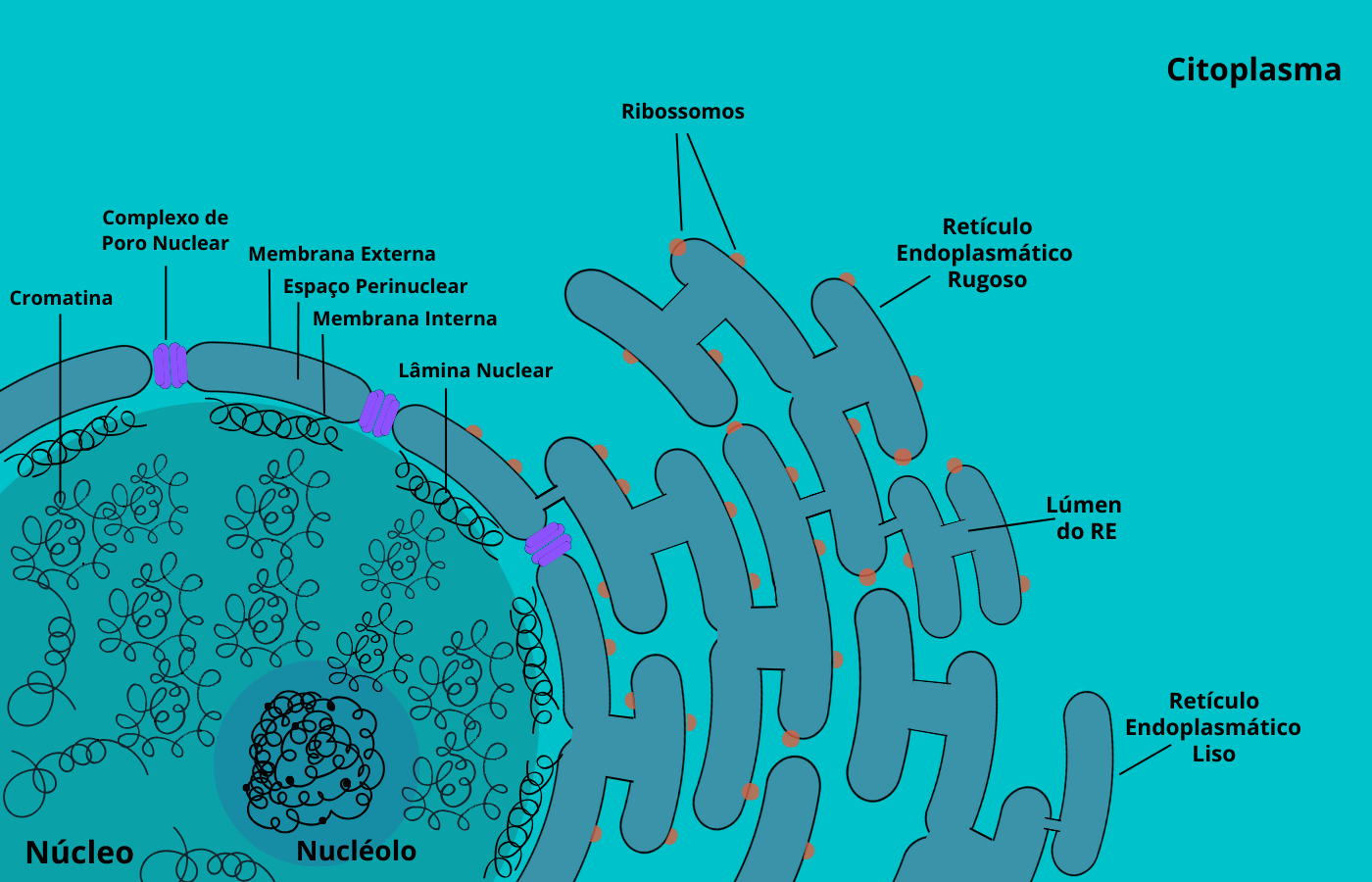
O envelope nuclear consiste em uma estrutura formada por uma dupla membrana (duas bicamadas lipídicas), estruturalmente similar à membrana plasmática, e pelos complexos de poros nucleares. Esta estrutura circunda o núcleo, separando o DNA do citoplasma. É dividido em membrana interna e externa. A membrana interna possui proteínas que estão ligadas à lâmina nuclear e também aos cromossomos, constituindo pontos de ancoragem e ligação, podendo ter participação na importação de proteínas específicas para o núcleo. A lâmina nuclear é composta de uma rede de filamentos intermediários de 8 a 10 nm de espessura, compostos por proteínas laminas A, B e C, situadas na periferia do nucleoplasma (nome dado ao conteúdo do núcleo) e abaixo da membrana nuclear interna. Em mamíferos há presença de quatro tipos de laminas (A, B1, B2 e C), sendo que todas são proteínas fibrosas. Sua presença confere suporte e estabilidade mecânica ao envelope nuclear além de ser responsável por ancorar os cromossomos. Há estudos que sugerem que a lâmina nuclear em seu funcionamento normal apresenta um papel importante na organização estrutural do núcleo, movimento dos cromossomos e replicação do DNA, que nos eucariotos que não possuem laminas (como as leveduras e outros não metazoários), há proteínas distintas com funções homólogas. Mutações nos genes que codificam as proteínas que compõem e constituem a lâmina nuclear (p. ex. nos genes LMNA, LMNB1, LMNB2), dão origem às laminopatias relacionadas a doenças como distrofias musculares, neuropatias e outras.
Ainda sobre as laminas, estas são organizadas em um domínio amino-terminal pequeno, uma região central em α-hélice (formando uma estrutura do tipo coiled-coil, ‘corda enrolada’) e um domínio carboxi-terminal e assim como outros filamentos intermediários elas podem se associar formando dímeros, tetrâmeros, protofilamentos, filamentos e por último os retículos que constituem a lâmina nuclear. O primeiro passo é a formação dos dímeros onde duas laminas se enrolam nas porções de alfa hélice, parecendo uma corda e depois os dímeros se unem e sofrem algumas modificações pós-traducionais (como, por exemplo, alterações nas extremidades das moléculas) e associam-se a proteínas da membrana interna.
A membrana externa do envelope nuclear é contínua com cisternas do retículo endoplasmático rugoso, compartilhando características de sua membrana, como a presença de ribossomos. Desse modo, seu lúmen, denominado espaço perinuclear, é contínuo com o lúmen do retículo.
As membranas então protegem o material genético e ao isolar o núcleo criam um compartimento bioquímico distinto do restante da célula. Como vimos, cada membrana é uma bicamada fosfolipídica associada a proteínas e, portanto, não é qualquer molécula que as atravessa. De modo geral, fica restrito a pequenas moléculas não polares.
Pequenas moléculas polares e proteínas de baixo peso molecular (< 20 kDa, quilodáltons) conseguem passar para o interior do núcleo (ou do núcleo para o citoplasma) passivamente pelos complexos de poro enquanto que moléculas maiores, incluindo os RNAs e muitas proteínas, são grandes demais para isso e devem ser transportadas ativamente.
Figura 2 – Organização geral do núcleo. (Crédito: Isaias Cavalcante de Oliveira)
Complexo de Poro Nuclear
Os complexos de poro nuclear (ou simplesmente poros nucleares) são os grandes canais (cerca de 120 nm) que permitem a passagem de moléculas polares, íons e macromoléculas num fluxo bidirecional, entre núcleo e citoplasma. São constituídos por um conjunto de cerca de 30 diferentes proteínas, ou nucleoporinas (podendo chegar até 50-100 em vertebrados) sendo que a maioria está presente em várias cópias. Interessantemente, estudos demonstram que os poros são organizados em oito unidades estruturais mais um canal central. Estas unidades estruturais semelhantes a colunas atravessam o envelope e ficam ligadas aos sítios de fusão das membranas interna e externa, ancorando o complexo. Associadas a elas há nucleoporinas de suporte que formam arranjos em camadas de anéis e outras que delimitam o grande canal central. Ainda, no poro central há muitas nucleoporinas que tem suas cadeias polipeptídicas num formato “desordenado” formando um emaranhado proteico não permitindo a difusão passiva de macromoléculas grandes. Fibrilas se projetam em ambos os lados (citosólico e nuclear) dos complexos. Entretanto, as fibrilas voltadas para o lado nuclear convergem nas suas extremidades distais para formar uma estrutura semelhante a uma cesta de basquete.
O número de complexos de poros varia conforme o tecido e o tipo celular, tendo em média 3-4 mil em uma célula “típica” de um mamífero. É esperado então que células que necessitam de uma alta atividade de síntese de DNA e RNA e transporte tenham mais poros. As proteínas que vão desempenhar alguma função nuclear sintetizadas no citosol (citoplasma) como as histonas, DNA-polimerases e RNA-polimerases, reguladores de transcrição e proteínas de processamento de RNA são importadas para o compartimento nuclear. Concomitantemente, os RNAs como mRNAs (mensageiros), rRNAs (ribossômicos), tRNAs (transportadores), miRNAs (micro-RNAs) e snRNAs (pequenos RNAs nucleares) e as subunidades ribossômicas são sintetizados no núcleo e exportados para o citosol.

Figura 3 – Detalhe dos Complexos de Poro e lâmina nuclear (baseado em COOPER & HAUSMAN, 2007). (Crédito: Isaias Cavalcante de Oliveira)
Envelope Nuclear durante a Mitose
No processo de divisão celular (mitose) os cromossomos são condensados (compactados), o nucléolo é desfeito e o envelope nuclear se fragmenta e como você deve imaginar parte do retículo endoplasmático também. Os complexos de poros nucleares tem suas unidades e fibrilas dissociadas e a lâmina nuclear sofre despolimerização. Essa dissociação das nucleoporinas e a despolimerização das laminas se deve em parte a fosforilação por proteína-cinase (quinase) dependente de ciclina (Cdk), ativada no início da mitose. As cinases dependentes de ciclina são importantes na regulação da progressão do ciclo celular, tem certa especificidade quanto ao seu substrato e sua ativação depende de moléculas que são sintetizadas e degradadas durante o ciclo, as ciclinas. Um exemplo é a Cdc2 (proteinoquinase) que fosforila as laminas nucleares nas leveduras e a Cdk1, sua homóloga em vertebrados.
O destino destas estruturas fragmentadas varia um pouco. Parte das proteínas dos complexos de poros se ligam a receptores de importação nuclear, que estão relacionados com sua montagem ao final da mitose. Outras formam vesículas. As da membrana do envelope nuclear já “soltas” difundem-se pela membrana do retículo e as proteínas nucleares que não estão aderidas a membranas ou cromossomos misturam-se completamente com as proteínas citosólicas. Ademais, há nesse processo a participação de proteínas motoras como as dineínas, que “caminham” ao longo dos microtúbulos, tracionando organelas ou partes dessas, e participam ativamente no rompimento do envelope nuclear. Assim, esses eventos quebram as barreiras que costumam separar o núcleo e o citosol momentaneamente e próximo final da divisão celular, há um rearranjo do envelope nuclear na superfície dos cromossomos-filhos. Cabe citar que há exceções. Em alguns eucariotos, como as leveduras, pode ocorrer a “mitose fechada”, onde o núcleo ao invés de se romper (e depois se refazer) é comprimido e se divide em dois junto com a célula, portando os cromossomos-filhos.
Transporte Nuclear
Afinal, como as moléculas são identificadas e “sabem” para onde ir? Pelos sinais de localização nuclear, que são sequências de aminoácidos que “endereçam” as moléculas e são reconhecidos pelos receptores de transporte dos compartimentos que as direcionam aos complexos de poros. Em geral, são sequências que contêm repetições de aminoácidos básicos como lisina e arginina (Lys, Arg) e aparentemente podem estar em diferentes regiões da molécula. Na importação, os sinais são reconhecidos por receptores de importação nuclear ou importinas, codificados por uma família de genes relacionados entre si. Essas importinas (proteínas solúveis do citosol) ficam ligadas àqueles emaranhados não estruturados do canal de nucleoporinas no centro do poro, que, em geral, possuem sequências repetidas de fenilalanina e glicina (Phe, Gly) e, ao mesmo tempo, se ligam aos sinais de localização nuclear da molécula/proteína-carga. Dessa forma, o complexo receptor-carga se movimenta ao longo da via de transporte, se ligando e dissociando, repetidas vezes, às sequências adjacentes contendo as repetições até chegar no interior do núcleo, onde os receptores de importação se soltam da sua carga e retornam ao citosol.
Essa dissociação ocorre apenas no lado nuclear dos poros, logo, há uma direcionalidade, um sentido ao processo de importação. O processo de exportação funciona de forma semelhante através dos receptores de exportação nuclear ou exportinas e de sinais de exportação nuclear, no sentido oposto. Os receptores se ligam tanto ao sinal de exportação quanto às proteínas dos poros guiando sua carga ao citosol, e muitos desses receptores compartilham semelhanças estruturais com os receptores de importação nuclear e são codificados pela mesma família de genes dos receptores de transporte nuclear (também denominados carioferinas). Fantástico não?
O transporte ocorre de uma forma organizada, entre outras razões, devido à proteína Ran que utiliza GTP como forma de energia, hidrolisando-o a GDP. Como funciona? Basicamente a troca entre os dois estados de conformação da proteína Ran se dá pela ação de duas proteínas reguladoras específicas, uma proteína ativadora de GTPase (GAP, de GTPase-activating protein) citosólica, que estimula a hidrólise (quebra) de GTP e um fator de troca de guanina (GEF, de guanine exchange factor) nuclear, que promove a troca de GDP para GTP convertendo Ran-GDP em Ran-GTP. Logo, do lado citosólico há uma concentração de Ran-GDP e do lado nuclear Ran-GTP. Em um primeiro momento o sinal de localização nuclear é reconhecido por uma importina associada à Ran-GDP. Depois, o complexo formado (carga/importina/Ran-GDP) se liga a uma proteína do poro, voltada para o citosol. O complexo então vai se deslocando através do poro ligando e desligando-se das proteínas e sequências interna ao poro até o GEF no núcleo substituir o GDP por GTP na proteína Ran, alterando a conformação do complexo e assim liberando a carga. Por fim, o complexo importina/Ran-GTP retorna ao poro e a GAP hidrolisa o GTP ligado a Ran, no citoplasma. O processo é cíclico. Desse modo, a proteína Ran atua na importação e exportação nuclear e neste último caso, a Ran-GTP no núcleo promove a ligação da carga ao receptor de exportação, ao invés de promover sua dissociação.
Por fim, existem proteínas que transitam de modo contínuo entre o citosol e o núcleo e outras que possuem um acesso limitado a estes compartimentos. As células desenvolveram diferentes estratégias para controlar o transporte dessas moléculas e uma delas é regulando a localização nuclear e os sinais de exportação “ligando” e “desligando”, por fosforilação de aminoácidos perto das sequências sinal. Há outros casos em que as moléculas (proteínas, fatores de transcrição, etc.) tem suas sequências sinal “disfarçadas” por proteínas inibitórias no citosol por meio de pequenas modificações em sua estrutura, garantindo que estas moléculas permaneçam no citoplasma por mais tempo. Isso é importante, pois garante que só com determinados estímulos ou em um momento específico do ciclo celular essas moléculas sejam transportadas e atuem na fisiologia celular.
A exportação de RNAs (principalmente mRNAs) e subunidades ribossômicas (40s e 60s) pode ocorrer conjuntamente em grandes “pacotes” (de até 100 milhões de dáltons!) exportados em associação a algumas ou centenas de proteínas. Esses complexos ribonucleoproteicos contendo mRNAs (ou mRNPs) ligam-se ao lado nuclear dos poros, onde são constantemente remodelados. Acredita-se que muitas proteínas acessórias presas aos poros nucleares e fibrilas citoplasmáticas tenham importantes papéis na reestruturação dos mRNPs que saem para o lado citosólico, garantindo a direcionalidade do transporte e ao fim do processo, essas proteínas nucleares do mRNP retornam ao núcleo, podendo então iniciar um novo ciclo.
Organização do Núcleo
Complexo de Poro Nuclear
O Nucléolo
Quando estudamos o núcleo celular, uma das suas estruturas mais evidentes é o nucléolo. Trata-se de uma estrutura densa e esférica, não circundada por membrana, um conjunto de muitas proteínas e vários tipos de RNAs e alças de DNA contendo seus genes, além de enzimas como as ATPases, polimerases e helicases. Encontramos principalmente os genes do rRNA e seus precursores, rRNAs maduros, proteínas ribossômicas e suas subunidades em formação. Portanto, o nucléolo é responsável por produzir os ribossomos e está envolvido com o processamento de RNAs. Sabe-se que células em alta atividade apresentam elevada síntese de proteínas para desempenhar suas respectivas funções biológicas. Dado que a síntese proteica ocorre nos ribossomos e eles são formados no nucléolo (suas subunidades), conclui-se que, células em alta atividade possuem nucléolos grandes e evidentes quando vistos em microscopia. Ainda, o nucléolo é o centro de produção de outros RNAs não codificadores e da organização de outros complexos RNA-proteína. Por exemplo, nas modificações feitas em tRNAs (RNAs transportadores), na telomerase e em partículas de reconhecimento de sinal que também são formadas no nucléolo. Em termos de morfologia, podemos subdividir o nucléolo em três regiões: componente fibrilar denso, centro fibrilar e componente granular. Estas regiões estão relacionadas aos diferentes estágios de formação das subunidades ribossômicas e sua exportação, como veremos a seguir.
Figura 4 – Microscopia eletrônica de transmissão contendo um núcleo de uma célula acinosa pancreática do morcego marrom (Myotis lucifugus). É possível observar os complexos de poro no envelope nuclear (setas), cromatina (eucromatina e heterocromatina) e nucléolo, além do retículo endoplasmático. Ref: https://doi.org/doi:10.7295/W9CIL11045 | Don W. Fawcett (2011) CIL:11045 (CC BY-NC-ND 3.0)

Montagem dos ribossomos
Antes de entendermos como ocorre a produção dos ribossomos propriamente dita, é preciso que você se lembre de que os rRNAs recebem um nome de acordo com as suas taxas de sedimentação em ultracentrifugação, e, portanto, tem a letra “S” ao final do nome. Quanto maior o valor de “S”, maior é o rRNA. Em um primeiro momento, os genes para os RNAs ribossomais 5.8S, 18S e 28S são transcritos no nucléolo pela RNA Polimerase I, formando uma unidade, o pré-rRNA45S. Logo em seguida ele sofre modificações e clivagens gerando o rRNA 18S que vai fazer parte da subunidade 40S (a subunidade menor). Os rRNAs 5.8S e 28S vão fazer parte da subunidade 60S (a subunidade maior). Na subunidade 60S, em muitos eucariotos, também podemos encontrar o rRNA 5S sintetizado pela RNA polimerase III, fora da região do nucléolo. Estes genes estão presentes em múltiplas cópias nas células e são organizados em série, com exceção do 5S.
O nucléolo, a cada divisão celular, é formado por regiões organizadoras do nucléolo que são alças de DNA cujos produtos da transcrição são os rRNAs, repetidos em série separadas uma das outras por regiões não codificadoras. Estas regiões recrutam outros elementos do nucléolo, como fatores de processamento e outros componentes, até completar sua formação. Como já mencionado, o produto da transcrição destes genes, o pré-rRNA45S, sofre modificações por meio de pequenos RNAs nucleolares (snoRNA), associados a proteínas e pequenos RNAs nucleares (snRNA). Observe na ilustração a seguir. As abreviações ITS e ETS se referem aos espaçadores transcritos internos (entre as sequências) e espaçadores transcritos externos (nas “pontas”), respectivamente. Enquanto o pré-rRNA45S está sendo sintetizado, a polimerase II transcreve RNAs mensageiros que vão atuar na síntese de proteínas ribossomais no citoplasma. Estas vão sendo transportadas ao núcleo e vão se unindo ao pré-RNA que depois é clivado. Esse processo então dá formação a estruturas pré-ribossomais que consistem no pré-RNA sendo clivado nos rRNAs 5.8S, 18S e 28S e as proteínas ribossomais e o rRNA 5S se unindo. Após isso as subunidades são formadas e exportadas para o citoplasma, onde se unem quando há síntese proteica.

Figura 5 – Transcrição e processamento dos rRNAs e montagem dos ribossomos (baseado em COOPER & HAUSMAN, 2007). (Crédito: Isaias Cavalcante de Oliveira)
Cromatina
Se extraíssemos todo o DNA de uma célula somática e enfileirássemos cada uma das moléculas – uma após a outra – teríamos aproximadamente 2 metros de DNA por célula! Mas, como você deve imaginar, o material genético das células está altamente organizado e compactado. Quimicamente falando, o DNA é um longo polímero de unidades simples (monômeros) de nucleotídeos (com adenina, timina, citosina, guanina) cuja cadeia principal é formada por moléculas de açúcares e fosfato intercalados unidos por ligações do tipo fosfodiéster.
Durante o processo de compactação essas fitas de DNA linear se associam com proteínas histonas e não-histonas, formando a cromatina. Os nucleossomos (cerca de 10-30nm) consistem no agrupamento mais básico da cromatina e são basicamente moléculas de DNA ligadas a proteínas básicas, de baixo peso molecular. Consistem em unidades repetitivas compostas por oito unidades proteicas (duas unidades de cada uma das histonas estruturais: H2A, H2B, H3 e H4), envolto por um segmento de DNA de aproximadamente 150 pares de bases. A histona H1 atua auxiliando a estabilização da interação entre esse segmento de DNA e o octâmero. Essa estrutura não é totalmente fixa, sendo constantemente remodelada e “afrouxada” por complexos de remodelagem da cromatina que utilizam ATP como energia. As proteínas não-histonas (não-histônicas) possuem funções diversas e podem ser encontradas ligadas ao DNA ou dispersas no nucleoplasma, podendo participar dos processos de replicação do DNA, reparo do DNA, ativação e repressão gênica, por exemplo.
Essa sequência de repetidos nucleossomos dá origem à cromatina (do grego, chroma, “cor”, relacionado às suas propriedades de coloração). Na interfase é possível observar duas configurações diferentes da cromatina. A heterocromatina se refere a uma porção bem compactada, concentrada em regiões específicas do núcleo e que restringe a expressão gênica. Por ser mais compacta e “inativa” do ponto de vista da transcrição, corresponde a uma região mais escura quando vista em microscopia eletrônica. A eucromatina é, portanto, a porção mais clara e menos compactada, distribuída no núcleo e que possui muitos genes transcricionalmente ativos. Ainda, a heterocromatina pode ser descrita como facultativa ou constitutiva. A heterocromatina constituitiva é formada por sequências de DNA altamente repetitivas e está sempre condensada em todas as células de um mesmo organismo, associados a centrômeros e telômeros. A heterocromatina facultativa não contém DNA repetitivo e, em uma espécie e até no mesmo indivíduo, pode estar condensada em certas células e descondensada em outras. Um exemplo é o cromossomo X das células das fêmeas de mamíferos. Para evitar a síntese excessiva das proteínas codificadas pelos genes desses cromossomos, em relação às que seriam produzidas por machos (compensação de dose), as células somáticas de mamíferos fêmeas inativam um X, chamado de cromatina sexual ou corpúsculo de Barr.
A cromatina de modo geral associa-se a diversas moléculas de RNA necessárias aos processos de expressão gênica, replicação e reparo do DNA e também a proteínas que as enovelam e empacotam formando os cromossomos. As nossas células, com exceção dos gametas (n) e alguns tipos celulares, possuem duas cópias de cada cromossomo (2n), uma herdada da mãe e outra herdada do pai (cromossomos homólogos). No total são 46 cromossomos, sendo 22 pares comuns tanto para indivíduos masculinos quanto femininos (autossômicos) e os dois cromossomos sexuais X e Y (XY – masculino e XX – feminino). Muitos desses cromossomos estão presentes em diferentes regiões do núcleo formando domínios funcionais. Na mitose, especialmente na metáfase, é possível observar cromossomos praticamente todas as células eucarióticas, formando estruturas altamente condensadas (com duas cromátides-irmãs, unidas pelos centrômeros). Dois grandes complexos de proteínas são importantes nesse processo, o complexo condensina (relacionado à condensação do cromossomo) e o complexo coesina (manutenção da união entre as cromátides-irmãs). Isso garante que o DNA esteja bem protegido contra emaranhamento, degradação, agressões químicas e possa ser mais facilmente transportado na anáfase, fase de migração dos cromossomos na divisão celular.
Curiosamente, os espermatozoides (organizados em “cabeça” com núcleo e acrossomo, “peça intermediária” e “cauda”) contam com um outro grupo de proteínas empacotadoras, as protaminas. Estas são proteínas não-histonas e possuem um caráter básico, sendo ricas em arginina e cisteína, garantem estabilidade e maior compactação ao DNA, tendo o complexo DNA-proteína estabilizado por pontes dissulfídicas entre as protaminas. A estrutura formada se assemelha a um “donut” (rosca) ou toroide. O núcleo dos espermatozoides também é recoberto por um envelope nuclear com membrana interna e uma externa e possui uma matriz.
Além disso, a expressão gênica é um processo regulado pela estrutura da cromatina. Ela pode acontecer por modificações nas “caudas” das histonas (acetilação e metilação) e por modificações covalentes nos nucleotídeos, podendo ser específicas para a heterocromatina ou para a eucromatina. No primeiro caso, a regulação ocorre através da acetilação das histonas por enzimas (a ligação de radicais acetil aos aminoácidos básicos das histonas), deixando assim o DNA “livre” para ser transcrito. Inversamente, a deacetilação ocorre quando o radical acetil se desliga das histonas, levando-as a se associarem novamente à molécula de DNA. Já a metilação ocorre com adição de radicais metil a resíduos de arginina e lisina das histonas (especialmente a H3), em geral, levando a inativação transcricional. O DNA também pode ser metilado, e neste segundo caso, radicais metil são ligados às bases de citosina presentes nesta molécula, também impedindo a transcrição do código genético. Tais modificações atuam compactando e/ou descompactando (relaxando) a cromatina e influenciam o acesso de fatores de transcrição e outras maquinarias de transcrição ao DNA.
O Envelope Nuclear ao fim da mitose
Ao final da mitose, na telófase, ocorre uma gradual descondensação cromossômica e, ao mesmo tempo, formação de novos envelopes nucleares, sendo esse processo sinalizado pelas cinases (quinases) dependentes de ciclina já mencionadas (por exemplo, a Cdc2, que neste ponto é inativada). O envelope nuclear é formado a partir das vesículas que foram geradas anteriormente em seu rompimento somado às proteínas integrais de membrana, além da associação das unidades e fibrilas dos complexos de poros nucleares e polimerização e nova formação da lâmina nuclear. As membranas se ligam aos cromossomos e se fusionam umas às outras. Logo, o conteúdo citoplasmático torna a se isolar do conteúdo nuclear e as proteínas que possuem as sequências de localização nuclear são novamente importadas e o núcleo pode expandir o seu tamanho. Conforme os cromossomos descondensam a transcrição é retomada e o nucléolo reaparece iniciando sua atividade.
Outras estruturas (corpúsculos)
Além do nucléolo, o núcleo apresenta outros domínios morfo funcionais distintos, entre eles: os corpúsculos de Cajal, corpos PML e grãos de intercromatina. Os corpúsculos de Cajal (ou corpos enrolados) são estruturas esféricas envolvidos na biogênese de Pequenas Ribonucleoproteínas Nucleares (snRNPs) que são complexos RNA-proteína envolvidos no splicing de RNAs. Os corpos PML (ou PML-NB, Promyelocytic Leukemia Nuclear Bodies) ainda não bem conhecidos, são agregados proteicos que não acumulam RNA e tem como principal proteína a ‘PML’, uma proteína supressora de tumor de onde origina o nome. Assim como todo o núcleo, os corpos PML são estrutural e funcionalmente heterogêneos e dinâmicos. Estudos apontam que essa estrutura está envolvida na oncogênese e no processo de infecção viral, além de regular diversas funções celulares, incluindo respostas a danos no DNA, apoptose, senescência celular e até angiogênese. Por fim, os grãos de intercromatina, conhecidos como speckles, concentram fatores de splicing (proteínas e snRNPs). Estão relacionados ao processamento de mRNAs e são encontrados proximamente a genes que são muito expressos.
Territórios Cromossômicos
Descobertas recentes mostram que no núcleo, cada cromossomo pode ocupar uma região restrita chamada de território cromossômico. As regiões heterocromáticas de um cromossomo estão intimamente associadas à lâmina nuclear, posicionadas então na periferia do núcleo, enquanto a eucromatina, com regiões mais ricas em genes, ocupa uma posição mais mediana. Nas porções periféricas do território ficam genes mais ativos transcricionalmente, próximos aos canais que separam os cromossomos. Em algumas células os centrômeros e telômeros podem se agrupar em polos opostos um ao outro ao passo que em outras podem estar distribuídos radialmente. Na interfase, a cromatina forma alças (domínios com cerca de 50 a 100 kb de DNA) e quando genes são muito expressos as alças de cromatina bastante dobradas podem se expandir, se alongar e ocupar um volume maior dentro do núcleo, podendo ser visualizadas. Portanto, é possível concluir também que, conforme o grau de expressão e regulação de um gene, sua posição no núcleo pode mudar. Estudos mostram que sequências ativamente transcritas às vezes são encontradas fora de seu território cromossômico, sob a forma de uma alça distendida e quando os genes são “desligados” a alça se contrai. Em alguns organismos na interfase e prófase da meiose são encontrados cromossomos gigantes denominados cromossomos politênicos (em insetos como a mosca drosófila) e cromossomos plumosos (em oócitos de anfíbios), respectivamente.
Compactação do DNA nuclear
Referências
ALBERTS, B. et al. 2017. Biologia Molecular da Célula. 6ª ed. Artmed
ANDRADE, Larissa Mara de. Arquitetura da cromatina na região organizadora do nucléolo e o seu papel no controle da expressão dos genes ribossomais. Dissertação (Mestrado em Genética e Melhoramento de Plantas) – ESALQ-USP, Piracicaba, 2011. doi:10.11606/D.11.2011.tde-19102011-085333.
BELETTI, M. E. Cromatina espermática : quebrando paradigmas. Rev. Bras. Reprod. Anim., Belo Horizonte, v. 37, n. 2, p. 92-96, 2013. http://www.cbra.org.br/pages/publicacoes/rbra/v37n2/pag92-96%20(RB465).pdf
BERNARDI, R.; PANDOLFI, P. P. Structure, dynamics and functions of promyelocytic leukaemia nuclear bodies. Nature Reviews Molecular Cell Biology, v. 8, n. 12, p. 1006–1016, 2007. https://doi.org/10.1038/nrm2277
COOPER, G. M.; HAUSMAN, R. E. A Célula, Uma Abordagem Molecular. 3 ª ed. Porto Alegre: Artmed, 2007.
CELL IMAGE LIBRARY: http://cellimagelibrary.org/
FERNANDA, G. Identificação e caracterização de TcNUP-1, uma proteína de lâmina nuclear em Trypanosoma cruzi. UFPR. BR, 2016. https://acervodigital.ufpr.br/handle/1884/4981
FRANÇA, S. C. V. A. Laminopatias: da fisiopatologia à terapêutica. Universidade de Coimbra, 2016. https://estudogeral.uc.pt/handle/10316/48368
GUION, L. G.; SAPP, M. The Role of Promyelocytic Leukemia Nuclear Bodies During HPV Infection. Frontiers in Cellular and Infection Microbiology, v. 10, 19, 2020. doi:10.3389/fcimb.2020.00035
JUNQUEIRA, LUIZ C.; CARNEIRO, JOSÉ. Biologia celular e molecular. 9 ed. Rio de Janeiro: Guanabara Koogan, 2012
